题目内容
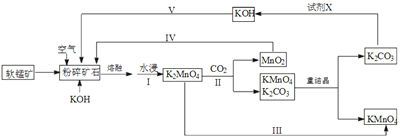
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿(主要成分是二氧化锰)制高锰酸钾的流程如下(部分条件和产物省略):
请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有______________________。
(2)写出向二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:___________________________________。
(3)从经济性考虑试剂X宜选择(填名称):___________。上述流程中,设计步骤IV和V的目的是____________________________________。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为___________________。
②电解过程中,阴极附近电解质溶液的pH将_______(填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色时,达到滴定终点。写出离子方程式:__________________。
(6)已知:常温下,Ksp [Mn(OH)2]=2.010-13。工业上,调节pH沉淀废水中Mn2+。当pH=10时,溶液中c(Mn2+)=______________。
【答案】加热、搅拌等 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 石灰乳(或生石灰) 循环利用二氧化锰、氢氧化钾,提高原料利用率 MnO42--e-=MnO4- 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ 增大 2.0×10-5mol/L
2K2MnO4+2H2O 石灰乳(或生石灰) 循环利用二氧化锰、氢氧化钾,提高原料利用率 MnO42--e-=MnO4- 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ 增大 2.0×10-5mol/L
【解析】
(1)为提高提高锰酸钾浸出率,应采用加热、搅拌的方法,使反应尽可能多的生成锰酸钾;
(2)根据流程图,二氧化锰与氢氧化钾溶液、氧气在高温条件下发生反应生成锰酸钾和水,化学方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(3)碳酸钾与X反应又得氢氧化钾,所以X试剂应是与碳酸钾发生复分解反应的物质,结合碳酸根离子的性质判断X是石灰乳或生石灰;设计步骤IV和V的目的是使氢氧化钾、二氧化锰重新被利用,提高原料的利用率;
(4)锰酸钾生成高锰酸钾,Mn元素的化合价升高,所以锰酸钾发生氧化反应,所以电解锰酸钾溶液的阳极反应式为锰酸根离子失去电子生成高锰酸根离子,电极反应式为MnO42--e-=MnO4-;阴极是氢离子放电生成氢气,氢离子浓度减小,氢氧根离子浓度增大,则溶液的pH增大;
(5)向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀,该黑色沉淀是二氧化锰,所以该滴定反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(6)Mn(OH)2的溶度积Ksp=c(Mn2+)c(OH-)2=2.0×10-13,当pH=10时,c(OH-)=1.0×10-4mol/L,所以c(Mn2+)=2.0×10-13/ c(OH-)2=2.0×10-5mol/L.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案