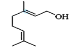
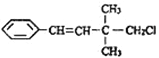
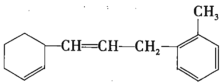题目内容
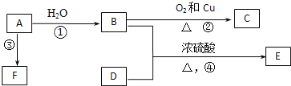
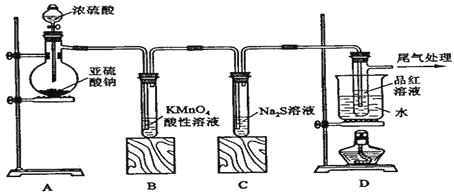
【题目】某校化学兴趣小组模拟利用氨气和次氯酸钠合成肼(N2H4)的过程。设计了如图装置:

(1)盛放浓盐酸的仪器名称是_______________。
(2)装置⑤中发生反应的化学方程式为____________________________________。
(3)在________(填图中的装置数字序号)装置中制备肼,发生反应的化学方程式为______________________________________________。
(4)②中盛装的试剂为_______________,作用是________________。
(5)肼是一种可燃性气体,可用作火箭燃料,与氧气或氮的氧化物反应时,生成物均无污染,写出肼和一氧化氮燃烧反应的化学方程式_____________________________ 。
【答案】分液漏斗 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O ③ 2NH3+NaClO=N2H4+NaCl+H2O NaOH溶液 吸收多余的Cl2 N2H4+2NO
CaCl2+2NH3↑+2H2O ③ 2NH3+NaClO=N2H4+NaCl+H2O NaOH溶液 吸收多余的Cl2 N2H4+2NO![]() 2N2+2H2O
2N2+2H2O
【解析】
由图可知,①中发生的反应为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,打开K1,Cl2能和NaOH溶液反应生成NaCl、NaClO,⑤用来制取氨气,④装置是安全瓶,能防倒吸,在③中氨气和NaClO反应生成N2H4,发生反应:ClO-+2NH3=N2H4+Cl-+H2O,最后关闭K1,②中装有NaOH溶液,用于吸收多余的Cl2,根据以上分析解答此题。
MnCl2+Cl2↑+2H2O,打开K1,Cl2能和NaOH溶液反应生成NaCl、NaClO,⑤用来制取氨气,④装置是安全瓶,能防倒吸,在③中氨气和NaClO反应生成N2H4,发生反应:ClO-+2NH3=N2H4+Cl-+H2O,最后关闭K1,②中装有NaOH溶液,用于吸收多余的Cl2,根据以上分析解答此题。
由图可知,①中发生的反应为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,打开K1,Cl2能和NaOH溶液反应生成NaCl、NaClO,⑤用来制取氨气,④装置是安全瓶,能防倒吸,在③中氨气和NaClO反应生成N2H4,发生反应:ClO-+2NH3=N2H4+Cl-+H2O,最后关闭K1,②中装有NaOH溶液,用于吸收多余的Cl2 ;
MnCl2+Cl2↑+2H2O,打开K1,Cl2能和NaOH溶液反应生成NaCl、NaClO,⑤用来制取氨气,④装置是安全瓶,能防倒吸,在③中氨气和NaClO反应生成N2H4,发生反应:ClO-+2NH3=N2H4+Cl-+H2O,最后关闭K1,②中装有NaOH溶液,用于吸收多余的Cl2 ;
(1)①为实验室制取氯气的装置,盛放浓盐酸的仪器为分液漏斗;
答案为:分液漏斗。
(2) ⑤用来制取氨气,化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(3) 在③中氨气和NaClO反应生成N2H4,发生反应:2NH3+NaClO=N2H4+NaCl+H2O ;
答案为:③;2NH3+NaClO=N2H4+NaCl+H2O 。
(4) ②中装有NaOH溶液,用于吸收多余的Cl2;
答案为:NaOH溶液;吸收多余的Cl2 。
(5) 肼与氧气或氮的氧化物反应时,生成物无污染,所以氮元素反应后生成氮气、氢元素生成水无污染,肼和一氧化氮反应的化学方程式为:N2H4+2NO![]() 2N2+2H2O;
2N2+2H2O;
答案为:N2H4+2NO![]() 2N2+2H2O。
2N2+2H2O。

【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%