题目内容
19.A、B、C、D 四种原子序数小于18 的元素,其离子 aA+、bB2+、cC-、dD2-具有相同的电子层结构,下列判断正确的是( )| A. | 原子序数的大小顺序是:B<A<C<D | |
| B. | 离子半径由大到小的顺序是:B2+>A+>C->D2- | |
| C. | A、B、C、D四种元素原子具有相同的电子层数 | |
| D. | 金属性A>B,非金属性C>D |
分析 aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,结合元素周期律递变规律解答该题.
解答 解:aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d.
A.由a-1=b-2=c+1=d+2可知,原子序数:B>A>C>D,故A错误;
B.aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,原子序数:b>a>c>d,核电核数越大,离子半径越小,则离子半径:dD2->cC->aA+>bB2+,故B错误;
C.A、B在周期表中C、D的下一周期,电子层数不同,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,金属性逐渐减弱,则金属性A>B,非金属性C>D,故D正确.
故选D.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
7.还原2.4molXO(OH)3+到X元素的低价态时,需消耗3mol/L的Na2SO3溶液2L,则在此反应中X元素的低价态为( )
| A. | 0价 | B. | +1价 | C. | -1价 | D. | -2价 |
11.有关晶体结构的叙述中,错误的是( )
| A. | 金刚石的网状结构中,最小的环上有6个碳原子 | |
| B. | 分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 在氯化铯晶体中,每个氯离子周围最近且等距离的氯离子有8个 |
8.下列说法正确的是( )
| A. | 用1L水里含有溶质物质的量来表示的浓度叫做物质的量浓度 | |
| B. | 用一定量溶液里含有溶质的多少来表示的浓度叫做物质的量浓度 | |
| C. | 用1L溶液里含有溶质的量来表示的浓度叫做物质的量浓度 | |
| D. | 用1L溶液里含有多少摩尔溶质来表示的浓度叫做物质的量浓度 |
 氨气
氨气
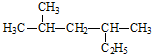 2,4-二甲基己烷
2,4-二甲基己烷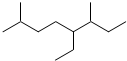 2,6-二甲基-5-乙基辛烷.
2,6-二甲基-5-乙基辛烷.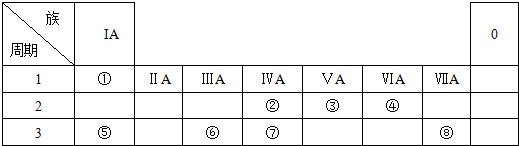
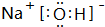
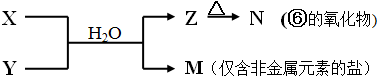
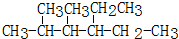
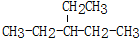 .
.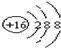 ,Br -的电子式:
,Br -的电子式: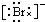 ,CO2的结构式:O=C=O
,CO2的结构式:O=C=O
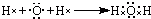 .
.