题目内容
15.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:(1)PCl5分解成PCl3和Cl2的热化学方程式PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1
(2)P和Cl2分两步反应生成1molPCl5的△H3=-399kJ•mol-1,P和Cl2一步反应生成1molPCl5的△H4等于△H3(填“大于”、“小于”或“等于”).
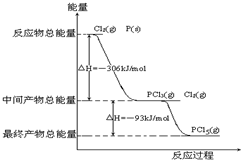
分析 根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用.
解答 解:(1)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(2)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热,
故答案为:-399kJ•mol-1;等于.
点评 本题考查热化学方程式的书写以及盖斯定律的应用,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
5.下列关于氧化还原反应的本质,叙述正确的是( )
| A. | 有电子转移 | B. | 有化合价升降 | C. | 得氧和失氧 | D. | 有电子得失 |
6.能说明苯酚酸性很弱的实验是( )
| A. | 常温下苯酚在水中的溶解度不大 | B. | 苯酚能跟NaOH溶液反应 | ||
| C. | 苯酚遇FeCl3溶液呈紫色 | D. | 将CO2通入苯酚钠溶液出现浑浊 |
3.据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质.下列说法正确的是( )
| A. | 18O2中含18个中子 | B. | 18O与16O中子数不同 | ||
| C. | N5和N2互为同位素 | D. | 2 N5=5 N2是化学变化 |
20.最近医学界通过用放射性15C跟踪标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关15C的叙述正确的是( )
| A. | 与C60中普通碳原子的化学性质不同 | |
| B. | 与16O的中子数相同 | |
| C. | 是足球烯的同素异形体 | |
| D. | 与12C互为同位素 |
7.下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A. | CsCl、SiO2、CBr4、CF4 | B. | SiO2、CsCl、CF4、CBr4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
4.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是( )
| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
5.化学反应的本质是旧的化学断裂新的化学键形成,即有新物质的生成,下列变化属于物理变化的是( )
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 氧气变臭氧 | D. | 乙烯通入溴水,溴水褪色 |
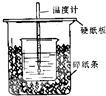 用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: