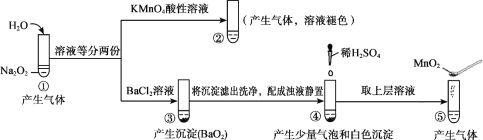
题目内容
【题目】(1)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
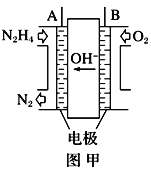
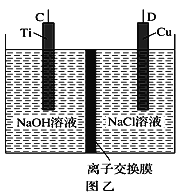
①上述装置中D电极应连接肼燃料电池的____极(填“A”或“B”),该电解池中离子交换膜为_____离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为____________
③当反应生成14.4 g Cu2O时,至少需要肼________ mol。
(2)利用下图丙装置,可以模拟铁的电化学防护。
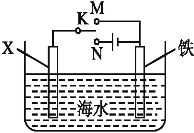
若X为碳棒,为减缓铁的腐蚀,开关K应置于_______处。若X为锌,开关K置于M处,该电化学防护法称为_________。
【答案】B 阴 2Cu-2e-+2OH-===Cu2O+H2O 0.05 N 牺牲阳极的阴极保护法
【解析】
(1)①燃料电池正极通氧化剂,负极通燃料,即A极为负极,B极为正极。图乙为电解池装置,电解目的为制备Cu2O,则D极作阳极,接电池正极(B极),铜被氧化。阳极反应为2Cu-2e-十2OH-=Cu2O+H2O,反应消耗OH-,采用阴离子交换膜使OH-向阳极移动。答案:B;阴极。
(2)根据上述分析,阳极反应为2Cu-2e-+2OH-===Cu2O+H2O;答案:2Cu-2e-+2OH-===Cu2O+H2O。
(3)根据电极反应2Cu-2e-+2OH-==Cu2O+H2O 和N2H4-4e-+4OH-=N2![]() +4H2O可知,Cu2O与N2H4、e-的数量关系式为4Cu2O
+4H2O可知,Cu2O与N2H4、e-的数量关系式为4Cu2O![]() N2H4
N2H4![]() 4e-,当反应生成14.4 g Cu2O(0.1mol)时,至少需要肼为0.025mol。答案:0.025mol。
4e-,当反应生成14.4 g Cu2O(0.1mol)时,至少需要肼为0.025mol。答案:0.025mol。
若X为碳棒,为减缓铁的腐蚀, 要采用外加电流的阴极保护法,所以为延缓铁腐蚀, 开关K应置于N处;。若X锌为减缓铁的腐蚀,开关K置于M处,该方法为牺牲阳极的阴极保护法。答案是:N;牺牲阳极的阴极保护法。

【题目】下表是元素周期表中短周期元素的一部分,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | ||||||||||||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||
⑨ | ⑩ | ||||||||||||||||
⑴上述元素中金属性最强和非金属性最强的元素名称分别是_____________;
(2) ⑥和⑦的气态氢化物稳定性比较(写化学式):_____________________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;其与④的最高价氧化物对应水化物反应的化学方程式为______________________________ 。
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是______________________________;
(5)比较⑦和⑨对应简单离子的离子半径大小(用相应离子符号表示)______________________________。
(6)写出⑨的最高价氧化物对应水化物的电子式____________________;其含有的化学键类型是_____________________________。
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
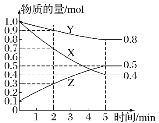
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。