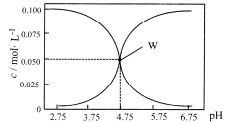
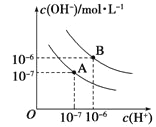
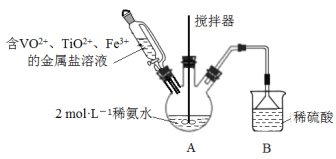
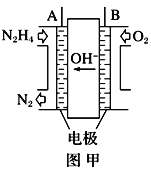
题目内容
【题目】下表是元素周期表中短周期元素的一部分,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | ||||||||||||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||
⑨ | ⑩ | ||||||||||||||||
⑴上述元素中金属性最强和非金属性最强的元素名称分别是_____________;
(2) ⑥和⑦的气态氢化物稳定性比较(写化学式):_____________________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;其与④的最高价氧化物对应水化物反应的化学方程式为______________________________ 。
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是______________________________;
(5)比较⑦和⑨对应简单离子的离子半径大小(用相应离子符号表示)______________________________。
(6)写出⑨的最高价氧化物对应水化物的电子式____________________;其含有的化学键类型是_____________________________。
【答案】钾 氟 HCl>PH3 Al(OH)3 + 3HClO4=Al(ClO4)3 + 3H2O 第3周期第ⅦA族 K+<Cl- K+![]() 离子键和共价键
离子键和共价键
【解析】
根据元素在周期表中的位置可知,①为N元素,②为F元素,③为Mg元素,④为Al元素,⑤为Si元素,⑥为P元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,⑩为Br元素,结合元素周期律分析解答。
根据元素在周期表中的位置可知,①为N元素,②为F元素,③为Mg元素,④为Al元素,⑤为Si元素,⑥为P元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,⑩为Br元素。
⑴同一周期,从左向右,金属性减弱,非金属性增强,同一主族,从上到下,金属性增强,非金属性减弱,上述元素中金属性最强的是钾,非金属性最强的是氟,故答案为:钾;氟;
(2) 元素的非金属性越强,最简单氢化物越稳定,非金属性P<Cl,则⑥和⑦的气态氢化物稳定性HCl>PH3,故答案为:HCl>PH3;
(3) 元素的非金属性越强,最高价氧化物对应水化物酸性越强,由于F无最高价氧化物对应的水化物,因此在上述元素中其最高价氧化物对应水化物酸性最强的酸为HClO4;其与④(Al)的最高价氧化物对应水化物反应的化学方程式为Al(OH)3 + 3HClO4=Al(ClO4)3 + 3H2O,故答案为:Al(OH)3 + 3HClO4=Al(ClO4)3 + 3H2O;
(4)氯气与水反应生成次氯酸和盐酸,将氯气通入到紫色石蕊溶液中的现象为先变红后褪色,Cl元素在周期表中位于第3周期第ⅦA族,故答案为:第3周期第ⅦA族;
(5) 电子层结构相同的离子,核电荷数越大,离子半径越小,⑦和⑨对应简单离子的离子半径大小顺序为K+<Cl-,故答案为:K+<Cl-;
(6)⑨的最高价氧化物对应水化物为KOH,属于离子化合物,电子式为K+![]() ;其中含有离子键和共价键,故答案为:K+
;其中含有离子键和共价键,故答案为:K+![]() ;离子键和共价键。
;离子键和共价键。

【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
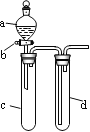
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是_________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是______________________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3,则分液漏斗a中加入的试剂是___________,c中加入的试剂是_________,d中加入的试剂是_________;实验现象为_______________________。
但此实验存在不足之处,改进的措施是___________________________。