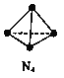
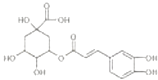
题目内容
【题目】氧化还原是一类重要的反应。
(1)已知反应2I-+2Fe3+=I2+2Fe2+,反应中还原剂是_________,氧化性Fe3+______I2 (填“ < ”或“ > ”) 。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,若转移3mol电子,则所产生的氧气在标准状况下的体积为___________L。
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,对系数m和R2+、R3+判断正确的是__。
A.m=y,R3+是还原剂 B.m=2y,R2+被氧化
C.m=2,R3+是氧化剂 D.m=4,R2+是还原剂
(4)用双线桥标出反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中电子转移的方向和数目_________。
(5)氯气和石英砂、碳粉共热可发生反应:SiO2+2C+2Cl2![]() SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
SiCl4+2CO当反应消耗6g碳时,生成还原产物_________mol。
【答案】 I- > 33.6 D  0.25
0.25
【解析】(1)碘离子氧化为碘单质,反应中做还原剂;Fe3+价态降低,发生还原反应,做氧化剂,碘单质为氧化产物,因此氧化性:Fe3+>I2;正确答案:I- ; >。
(2)在2Na2O2+2CO2=2Na2CO3+O2反应中,转移电子的量为2mol,生成氧气1 mol;若转移3mol电子,则所产生的氧气在标准状况下的体积为1.5×22.4= 33.6 L;
(3)在xR2++yH++O2═mR3++nH2O的离子方程式中,R2+→R3+,发生氧化反应,O2→H2O,发生还原反应,因此R2+是还原剂,被氧化,根据原子守恒规律可知:x=m, y=2n, 又知n=2,所以y=4,根据电荷守恒规律可知:2m+ y=3m,m=y=4,因此m=4,R2+是还原剂正确,正确答案:D。
(4)KMnO4中Mn元素为+7价降低到MnCl2中的+2价,2molKMnO4转移电子的量为2×5=10 mol;16molHCl(浓)中有10molHCl被氧化5mol Cl2,转移电子用双线桥标出电子转移的方向和数目如下: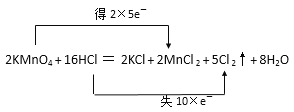 ;正确答案:
;正确答案: 。
。
(5)该反应中碳做还原剂,被氧化,对应氧化物产物为CO;氯气做氧化剂,被还原,对应还原产物为SiCl4,根据反应关系:2C--- SiCl4可知当反应消耗6g碳时(即0.5 mol)时, 生成SiCl4的量为0.25 mol,正确答案:0.25。

【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .