题目内容
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
①N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g) 2NO2(g) △H=+68 kJ/mol
则2NO(g)+O2(g) 2NO2(g) △H=_____kJ/mol
(2)对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是_____
a.整个反应的速率由第一步反应速率决定
b.同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
c.第二步反应速率慢,因而平衡转化率也低
d.第二步反应的活化能比第一步反应的活化能高
(3)将氨气与二氧化碳在有催化剂的反应器中反应![]() △H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
△H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
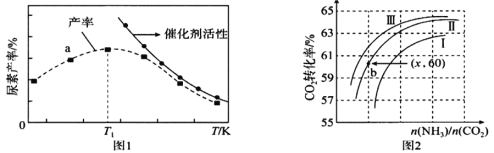
①a点_____(填是或不是)处于平衡状态,T1之后尿素产率下降的原因可能是 _____________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
(4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2ON2H5++OH- K1=![]() ;N2H5++H2ON2H62++OH - K2=
;N2H5++H2ON2H62++OH - K2=![]() ;
;
①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为__________。
【答案】-112 bd 不是 升高温度,平衡逆向移动,产率下降,且催化剂的活性降低 Ⅰ 4 14-b<pH<14-a (N2H6)(HSO4)2
【解析】
(1)根据盖斯定律分析解答;
(2)a.整个反应的速率由慢反应决定;
b.υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),反应达平衡时,υ正=υ逆,所以![]() =K(该化学平衡常数),据此进行分析;
=K(该化学平衡常数),据此进行分析;
c.反应速率与转化率无关;
d.相同温度下,第一步反应快速达到平衡,第二步是慢反应;据此分析判断;
(3)①产率最高之前,反应未达到平衡状态;结合温度对平衡移动及催化剂的影响回答;
②氨碳比相同时,增大水蒸气的含量,平衡逆向移动,二氧化碳的转化率减小,结合图象分析判断水碳比最大的曲线;根据图象,b点时,![]() =x,α(CO2)=60%,α(NH3)=30%,结合2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)计算解答;
=x,α(CO2)=60%,α(NH3)=30%,结合2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)计算解答;
(4)①N2H4+H2ON2H5++OH- K1=1×10-a;N2H5++H2ON2H62++OH- K2=1×10-b,根据平衡常数表达式结合c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),计算c(OH-)的范围,从而计算pH的范围;
②水合肼的性质类似一水合氨,在水中应该能电离产生N2H62+和OH-,据此分析判断与硫酸反应生成的酸式盐的化学式。
(1)已知①N2(g)+O2(g)2NO(g)△H=+180 kJmol-1,②N2(g)+2O2(g)2NO2(g)△H=+68 kJmol-1,根据盖斯定律,反应②-①得:2NO(g)+O2(g)=2NO2(g) △H=(-180+68)kJmol-1 =-112kJ/mol,故答案为:-112;
(2)a.整个反应的速率由慢反应决定,即由第二步反应速率决定,故a错误;
b.根据①同一温度下,平衡时第一步反应的![]() 越大,化学平衡常数越大,则反应正向进行程度越大,故b正确;
越大,化学平衡常数越大,则反应正向进行程度越大,故b正确;
c.反应速率的快慢与转化率无关,转化率与反应的限度有关,故c错误;
d.相同温度下,第一步反应快速达到平衡,第二步是慢反应,则第二步的活化能比第一步的活化能高,故d正确;
故答案为:bd;
(3)①产率最高之前,未达到平衡状态,故a点不是平衡点;反应为放热反应,达到平衡之后,升高温度,平衡逆向移动,产率下降,且催化剂的活性降低;
故答案为:不是;升高温度,平衡逆向移动,产率下降,且催化剂的活性降低;
②氨碳比相同时,增大水蒸气的含量,平衡逆向移动,二氧化碳的转化率减小,根据图象,氨碳比相同时,曲线Ⅲ的二氧化碳的转化率大,所以曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是为Ⅰ;根据图象,b点时,![]() =x,α(CO2)=60%,α(NH3)=30%,假设二氧化碳为1mol,则氨气为xmol,转化的二氧化碳为0.6mol,根据2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g),转化的氨气为1.2mol,则α(NH3)=
=x,α(CO2)=60%,α(NH3)=30%,假设二氧化碳为1mol,则氨气为xmol,转化的二氧化碳为0.6mol,根据2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g),转化的氨气为1.2mol,则α(NH3)=![]() ×100%=0.3,解得:x=4,故答案为:Ⅰ;4;
×100%=0.3,解得:x=4,故答案为:Ⅰ;4;
(4)①N2H4+H2ON2H5++OH- K1=1×10-a;N2H5++H2ON2H62++OH- K2=1×10-b,可知K1=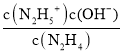 =1×10-a,K2=
=1×10-a,K2=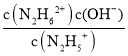 =1×10-b,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),则1×10-b<c(OH-)<1×10-a,即应控制溶液pH范围为14-b<pH<14-a,故答案为:14-b<pH<14-a;
=1×10-b,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),则1×10-b<c(OH-)<1×10-a,即应控制溶液pH范围为14-b<pH<14-a,故答案为:14-b<pH<14-a;
②水合肼的性质类似一水合氨,在水中应该能电离产生N2H62+和OH-,因此它与硫酸反应生成的酸式盐的化学式为(N2H6)(HSO4)2,故答案为:(N2H6)(HSO4)2。

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。

(1)Fe还原水体中NO3-的反应原理如图1所示。
①作负极的物质化学式为___________。
②正极的电极反应式是_________________________________________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_____________________________________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图2所示,可得到的结论是____________________。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________,解释加入Fe2+提高NO3-去除率的原因:_____________________________________。