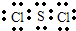题目内容
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子。根据以上叙述,下列说法中正确的是
A.上述四种元素的原子半径大小为W<X<Y<Z<M
B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2
C.元素W与氢形成的原子个数比为1﹕1的化合物有很多种
D.X与Y可形成含有非极性共价键的共价化合物
【答案】
C
【解析】
试题分析:在短周期原子序数依次增大的主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍,则W为C元素;X和Z的A2B型氢化物均为V形分子,则X为O元素;Z为S元素;Y的+1价离子比M的-1价离子少8个电子。则Y为Na元素,M为Cl元素。A.在元素周期表中,同周期的元素,原子序数越大,原子半径越小;在不同周期的元素中,原子核外的电子层数越多,原子半径越大。所以这几种元素的原子半径大小关系为:Na>S>Cl>C >O。B.由这些元素形成的三原子分子中,空间结构为直线形的有CO2,CS2,而SO2则为V型分子。C.元素C、H形成的1﹕1的化合物有C2H2、C6H6、C8H8等。正确。D.Na、O两元素可以形成Na2O、Na2O2两种化合物,它们都是离子化合物。错误。
考点:考查元素的推断及原子半径、化合物的性质与结构的知识。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目