题目内容
(11分)(1)一定温度下,在恒容密闭容器中N2O5可发生下 列反应:2N2O5(g)
列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、
“减小”或“不变”)。
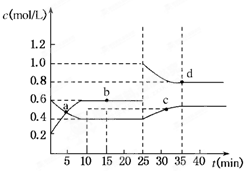
②下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为 。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2 T1。(填“>”、“<” 或 “ =”)
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的 区 (填“阳极”或“阴极”)生成,其电极反应式为 。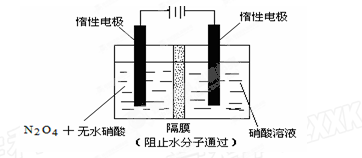
 列反应:2N2O5(g)
列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、
“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 10 00 00 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2 T1。(填“>”、“<” 或 “ =”)
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的 区 (填“阳极”或“阴极”)生成,其电极反应式为 。

1)不变 2分 0.00296 mol·L—1·s—1 2分 <或小于 2分
(2)阳极2分 N2O4+2HNO3—2e—=2N2O5+2H+ 3分
(2)阳极2分 N2O4+2HNO3—2e—=2N2O5+2H+ 3分
略

练习册系列答案
相关题目
 CO2(g
CO2(g CO(g) + H2O(g),其平衡常数K和温度t的关系如下:
CO(g) + H2O(g),其平衡常数K和温度t的关系如下: N2O4 (g) △H=" -92.4kJ/mol " 达到化学平衡状态且其它条件不变时,
N2O4 (g) △H=" -92.4kJ/mol " 达到化学平衡状态且其它条件不变时, cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。
cC(g),在温度分别为T1和T2,压强分别为P1和P2条件下,得到C的物质的量n与时间t的关系曲线如下图所示。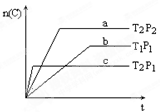
 2AB(g) 达到化学平衡的标志是( )
2AB(g) 达到化学平衡的标志是( ) CO2+H2,达平衡后测得CO2为0.75 mol再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为
CO2+H2,达平衡后测得CO2为0.75 mol再通入6 mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和可能为 pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了
pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了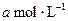 ,B的浓度减少了
,B的浓度减少了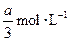 ,C的浓度增加了
,C的浓度增加了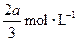 ,然后增大容器容积, A、 B、C的体积分数不变,则m∶n∶p∶q为( )
,然后增大容器容积, A、 B、C的体积分数不变,则m∶n∶p∶q为( )