题目内容
【题目】“足球烯”C60是一种外形类似足球状的分子,关于C60的说法错误的是( )
A.C60是一种新型的化合物B.C60的相对分子量为720
C.C60和金刚石互为同素异形体D.C60硬度比金刚石小
【答案】A
【解析】
由信息可知,它的分子具有空心的类似足球状的结构,分子式为C60,则该物质为单质,只含共价键,形成的为分子晶体,以此来解答。
A.C60是一种碳元素组成的单质,不是新型的化合物,故A错误;
B.C60是相对分子量=60×12=720,故B正确;
C.C60和金刚石是同种碳元素组成的不同单质互为同素异形体,故C正确;
D.C60是分子晶体,金刚石为原子晶体,硬度比金刚石小,故D正确;
答案选A。

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.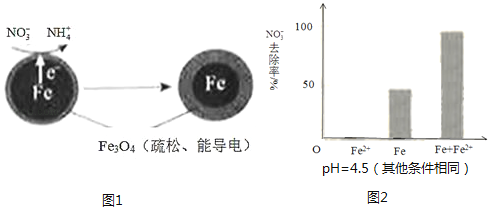
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
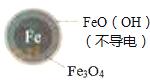
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
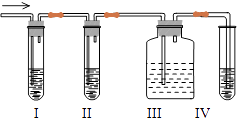
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .