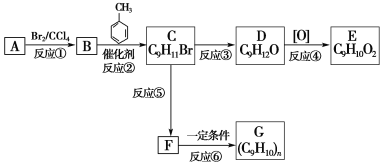
题目内容
【题目】氯气的用途非常广泛。实验室用如下装置制取氯气,并用制取氯气进行性质探究实验。回答下列问题:
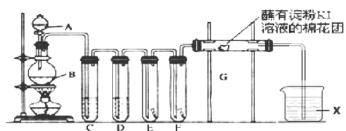
(1)A中盛有浓盐酸,B中盛有![]() ,写出反应的离子方程式__________________。
,写出反应的离子方程式__________________。
(2)E中为红色干布条,F中为红色湿布条,对比E和F中观察现象的差异可得出的结论是__________________。
(3)试管C和D中试剂名称各为_____________________。X试剂的作用是______________。
(4)装置G处发生反应的离子方程式为_____________________________。
(5)家庭中常用消毒液(主要成分![]() )与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒氯气,写出反应的离子方程式____________。
②需“密闭保存”的原因_________________________________。
【答案】MnO2+Cl-+4H+![]() Mn2+ +Cl2↑+2H2O 氯气不具有漂白性,具有漂白性的为次氯酸 饱和食盐水、浓硫酸 吸收多余氯气,防止污染空气 Cl2+2I-=2Cl-+I2 Cl-+ClO-+2H+=Cl2↑+H2O 消毒液的有效成分NaClO能与空气中的CO2作用,使其变质
Mn2+ +Cl2↑+2H2O 氯气不具有漂白性,具有漂白性的为次氯酸 饱和食盐水、浓硫酸 吸收多余氯气,防止污染空气 Cl2+2I-=2Cl-+I2 Cl-+ClO-+2H+=Cl2↑+H2O 消毒液的有效成分NaClO能与空气中的CO2作用,使其变质
【解析】
实验室用浓盐酸与二氧化锰加热反应制备氯气,浓盐酸具有挥发性,制备的氯气中含有氯化氢、水,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,依次通过干燥有色布条、湿润有色布条验证氯气是否具有漂白性,再通过G装置验证氯气的氧化性,氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气,据此分析解答。
(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故离子方程式为:MnO2+Cl-+4H+
MnCl2+Cl2↑+2H2O,故离子方程式为:MnO2+Cl-+4H+![]() Mn2+ +Cl2↑+2H2O,故答案为:MnO2+Cl-+4H+
Mn2+ +Cl2↑+2H2O,故答案为:MnO2+Cl-+4H+![]() Mn2+ +Cl2↑+2H2O;
Mn2+ +Cl2↑+2H2O;
(2)干燥的氯气依次通过E中红色干布条,F中红色湿布条,看到现象为E中布条不褪色,F中布条褪色,说明氯气不具有漂白性,具有漂白性的为次氯酸;故答案为:氯气不具有漂白性,具有漂白性的为次氯酸;
(3)制得的氯气混有HCl气体和水蒸气,由C中饱和食盐水除去HCl,D中浓硫酸吸收水蒸气,氯气有毒不能直接排放到空气中,由于氯气能够与碱反应,产生容易溶于水的物质,所以可以用氢氧化纳溶液作吸收试剂,吸收过量的氯气,故答案为:饱和食盐水、浓硫酸;吸收多余氯气,防止污染空气;
(4)G是浸有淀粉KI溶液的棉花球,氯气将KI氧化生成碘单质,故离子方程式为Cl2+2I-=2Cl-+I2,故答案为:Cl2+2I-=2Cl-+I2;
(5)①次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O,故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
②消毒液有效成分是次氯酸盐与二氧化碳和水生成的次氯酸,次氯酸不稳定,见光分解,所以应该密封保存,故答案为:消毒液的有效成分NaClO能与空气中的CO2作用,使其变质。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】一种由明矾石[主要成分:KAl3(SO4)2(OH)6]和地开石[主要成分:Al4(Si4O10)(OH)8]提取K2SO4和Al的工艺流程:

已知:K2SO4在不同温度下的溶解度
温度/℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 9.3 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
回答下列问题:
(1)硫酸熟化工艺是指浓硫酸在矿物颗粒表面均匀分布并向内扩散的过程,该过程中矿物颗粒_____(填“是”或“不是”)越细越好。
(2)完成并配平还原焙烧时明矾石与硫反应的化学方程式:________
![]() KAl3(SO4)2(OH)6+
KAl3(SO4)2(OH)6+![]() S→
S→![]() K2SO4+
K2SO4+![]() Al2O3+
Al2O3+![]() ___________+
___________+![]() H2O
H2O
(3)从水浸后的滤液中得到K2 SO4晶体的操作a是 _____,写出K2SO4的一种用途 _____ .
(4)碱浸过程中发生的主要反应的离子方程式为____、 ____ 。
(5)流程中制Al的化学方程式为________________________
(6)现利用还原焙烧产生的SO2来生产硫酸。若明矾石的质量为41.4t,主要成分含量为50%,SO2的利用率为96%,则可生产质量分数为98%的硫酸____t。[KAl3(SO4)2(OH)6的相对分子质量为414]
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。