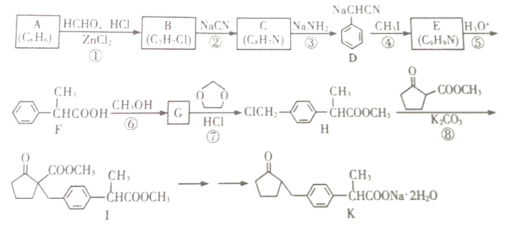
题目内容
【题目】一种由明矾石[主要成分:KAl3(SO4)2(OH)6]和地开石[主要成分:Al4(Si4O10)(OH)8]提取K2SO4和Al的工艺流程:

已知:K2SO4在不同温度下的溶解度
温度/℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 9.3 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
回答下列问题:
(1)硫酸熟化工艺是指浓硫酸在矿物颗粒表面均匀分布并向内扩散的过程,该过程中矿物颗粒_____(填“是”或“不是”)越细越好。
(2)完成并配平还原焙烧时明矾石与硫反应的化学方程式:________
![]() KAl3(SO4)2(OH)6+
KAl3(SO4)2(OH)6+![]() S→
S→![]() K2SO4+
K2SO4+![]() Al2O3+
Al2O3+![]() ___________+
___________+![]() H2O
H2O
(3)从水浸后的滤液中得到K2 SO4晶体的操作a是 _____,写出K2SO4的一种用途 _____ .
(4)碱浸过程中发生的主要反应的离子方程式为____、 ____ 。
(5)流程中制Al的化学方程式为________________________
(6)现利用还原焙烧产生的SO2来生产硫酸。若明矾石的质量为41.4t,主要成分含量为50%,SO2的利用率为96%,则可生产质量分数为98%的硫酸____t。[KAl3(SO4)2(OH)6的相对分子质量为414]
【答案】不是 4KAl3(SO4)2(OH)6+3S===2K2SO4+6Al2O3+9SO2↑+12H2O 蒸发结晶 作钾肥、制备钾盐、药物、玻璃、明矾等 Al2O3+2OH-===2AlO2-+H2O SiO2+2OH-===SiO32-+H2O 2Al2O3(熔融)![]() 4Al+3O2↑ 10.8
4Al+3O2↑ 10.8
【解析】
由工艺流程可知,地开石、明矾石经硫酸熟化后加入硫单质进行还原焙烧,明矾石发生反应4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O,地开石发生反应Al4(Si4O10)(OH)8=4SiO2+2Al2O3+4H2O,焙砂的主要成分为K2SO4、SiO2和Al2O3,再通过水浸后得到水浸出液K2SO4溶液和水浸出渣SiO2、Al2O3,结合K2SO4的溶解度随温度的变化可知,K2SO4溶液经蒸发结晶得到K2SO4晶体,水浸出渣Al2O3与SiO2分别与NaOH发生反应生成NaAlO2和Na2SiO3,再经一些列操作得到Al单质,据此分析解答问题。
(1)矿物颗粒细,可以提高扩散速率,但颗粒细度达到一定值后,再往后对速率的影响微乎其微,因此,硫酸熟化过程中矿物颗粒不是越细越好,故答案为:不是;
(2)根据上述分析,明矾石与硫发生氧化还原反应,硫作还原剂,KAl3(SO4)2(OH)6作氧化剂,根据氧化还原反应得失电子守恒进行配平可得,化学反应方程式为4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O,故答案为:4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O;
(3)K2SO4的溶解度虽然随着温度的升高而增大,但是变化不大,因此K2SO4溶液可采用蒸发结晶得到K2SO4晶体。K2SO4可用作钾肥,制加盐、药物、玻璃、明矾等,故答案为:蒸发结晶;作钾肥、制备钾盐、药物、玻璃、明矾等;
(4)碱浸过程中,主要是Al2O3与SiO2分别与NaOH发生反应,生成NaAlO2和Na2SiO3,离子反应方程式为Al2O3+2OH-===2AlO2-+H2O;SiO2+2OH-===SiO32-+H2O;故答案为:Al2O3+2OH-===2AlO2-+H2O;SiO2+2OH-===SiO32-+H2O;
(5)流程中制备Al可采用电解熔融Al2O3的方法,发生的化学反应方程式2Al2O3(熔融)![]() 4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(6)根据明矾石与硫反应方程式和元素守恒可得关系式:

则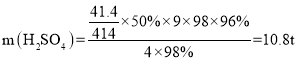 ,故答案为:10.8。
,故答案为:10.8。

 阅读快车系列答案
阅读快车系列答案