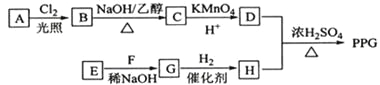
题目内容
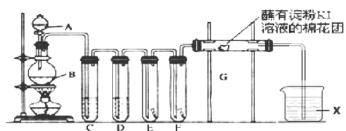
【题目】学生利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

回答下列问题:
(1)所用铁粉中若有杂质,欲除去不纯铁粉中混有的铝粉可以选用的试剂为_____________(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸 D.FeCl3溶液
此步涉及反应的离子方程式为_____________________________________。
(2)反应发生后装置B中发生反应的化学方程式是______________________________。D装置的作用:________________________________________________。
(3)该小组学生把B中反应后的产物加入足量的盐酸,过滤,用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
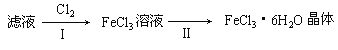
①用离子方程式表示步骤I中通入Cl2的作用__________________________________;
②为了检验某未知溶液是否是FeCl2溶液,同学们设计了以下实验方案加以证明。向一支装有该未 知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl2溶液。你认为此方案是否合理_______________(填“合理”或“不合理”)。
【答案】B 2Al+2OH-+2H2O=2![]() +3H2↑ 3Fe + 4H2O
+3H2↑ 3Fe + 4H2O![]() Fe3O4+ 4H2 除去H2中的水蒸气 Cl2+ 2Fe2+=2Fe3++2Cl- 不合理
Fe3O4+ 4H2 除去H2中的水蒸气 Cl2+ 2Fe2+=2Fe3++2Cl- 不合理
【解析】
(1)A.Fe、Al都能溶于稀盐酸,不能用稀盐酸除去铁粉中的铝粉;
B.Fe与NaOH溶液不反应,Al溶于NaOH溶液生成偏铝酸钠溶液,可选用NaOH溶液除去铁粉中的铝粉;
C.常温下,Fe、铝与浓硫酸都发生钝化,不能用浓硫酸除去铁粉中混有的铝粉;
D.Fe、Al都能溶于FeCl3溶液,不能用FeCl3溶液除去铁粉中的铝粉;
答案选B;
该反应的离子方程式是2Al+2OH-+2H2O=2![]() +3H2↑;
+3H2↑;
(2)装置B中Fe与水蒸气发生反应的化学方程式是3Fe + 4H2O(g)![]() Fe3O4+ 4H2;D装置的作用干燥氢气(或除去氢气中的水蒸气);
Fe3O4+ 4H2;D装置的作用干燥氢气(或除去氢气中的水蒸气);
(3)① Fe3O4与盐酸发生反应:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,因此滤液中含有FeCl3和FeCl2,向其中通入氯气,发生反应:Cl2+ 2Fe2+=2Fe3++2Cl-;然后将溶液蒸发浓缩,冷却结晶就得到FeCl3·6H2O。
②由于Fe3++3SCN-=Fe(SCN)3,溶液是红色的,即使原来的溶液完全是Fe3+,同样会发生上述现象,因此此方案不合理。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案