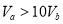题目内容
3.短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列判断正确的是( )| A. | 质子数a>b>c>d | B. | 离子的还原性Y2->Z- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 元素的金属性:W>X |
分析 短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Mg元素,X为Na元素.
A.根据核外电子数目相等判断;
B.非金属性越强,阴离子还原性越弱;
C.非金属性越强氢化物越稳定性;
D.同周期自左而右金属性增强.
解答 解:短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Mg元素,X为Na元素.
A.核外电子数相等,所以a-2=b-1=c+2=d+1,故质子数:a>b>d>c,故A错误;
B.非金属性O<F,故离子的还原性O2->F-,故B正确;
C.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HF>H2O,故C错误;
D.同周期自左而右金属性增强,故金属性Mg<Na,故D错误;
故选B.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.

练习册系列答案
相关题目
14.分别处于元素周期表第2、3周期的主族元素A和B,它们离子的核外电子层相差两层.已知A处于第m族,B处于第n族,且A只有正化合价.则A、B两元素的原子序数分别为( )
| A. | m、n | B. | m-2、10-n | C. | m+2、n+10 | D. | m+8、n+10 |
18.下列微粒中,既含有离子键又含有共价键的是( )
| A. | NH3 | B. | NH4Cl | C. | H2S | D. | KCl |
8.俄美两个实验室经过长期合作,共同合成出两个超重化学元素,国际理论与应用化学联合会(IUPAC)在5月30日宣布了这两个元素的新名字.第114号元素(位于周期表第七周期ⅣA族)命名为flerovium,其化学符号为Fl,是以俄罗斯弗雷洛夫核反应实验室(the Flerov Laboratory of Nuclear Reactions)的名字命名;第116号元素命名为livermorium,其化学符号为Lv,是以加州劳伦斯利弗莫尔国家实验室(the Lawrence Livermore National Laboratory)的名字命名.下列有关说法错误的是( )
| A. | Fl有+2,+4价 | |
| B. | Fl的失电子能力比同主族的铅弱 | |
| C. | Lv的最高价氧化物对应水化物是强酸 | |
| D. | Lv的电子层数比最外层电子数多1 |
15.下列各反应的化学方程式中,属于水解反应的是( )
| A. | H2CO3+H2O?H3O++HCO3- | B. | HCO3-+H2O?OH-+H2CO3 | ||
| C. | HCO3-+OH-?H2O+CO32- | D. | HCO3-+H2O?H3O++CO32- |
3.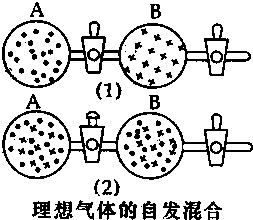 在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
 在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )
在图(1)中A、B两个容器里,分别收集着两个作用不同的理想气体.若将中间活塞打开[如图(2)],两种气体分子立即都占有了两个容器.这是一个不伴随能量变化的自发过程.关于此过程的下列说法不正确的是( )| A. | 此过程是从混乱程度小的向混乱程度大变化过程,即熵增大的过程 | |
| B. | 此过程为自发过程,而且没有热量的吸收或放出 | |
| C. | 此过程从有序到无序,混乱度增大 | |
| D. | 此过程是自发可逆的 |
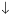 +2NO
+2NO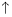 +4H+
+4H+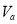 和
和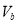 ,则
,则