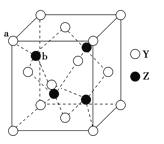
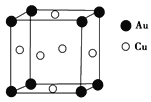
��Ŀ����
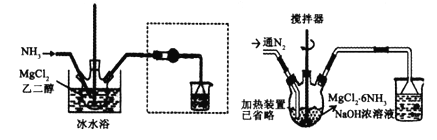
����Ŀ��ij�о���ѧϰС����̽�������Ļ�ѧ���ʣ������ͼ��ʾ��ʵ��װ�á�

��֪����װ�����������ã�ͭ�۷�������������(��ֹӲ�ʲ�����ը��)��
��ش��������⣺
��1��Ϊ��ֹͭ������е�������Ӧ���ڼ���֮ǰӦ�ý��еIJ���Ϊ____��
��2�����۲쵽AgNO3��Һ�г��ְ�ɫ����ʱ����ȼ�ƾ��Ƽ��ȣ�д��AgNO3��Һ�з�����Ӧ�Ļ�ѧ����ʽ��____��
��3��Ӳ�ʲ������еķ�Ӧ����Ϊ____����Ӧ�Ļ�ѧ����ʽΪ____��
��4��װ���п��Թܵ�������____��
��5��ʵ���У��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ____��
��6���ձ�������������Һ��������___��������Ӧ�Ļ�ѧ����ʽΪ_____��
��7��ʢˮ���Թ��У���Һ������ɫΪ___��˵������____(������������������)����ˮ��
���𰸡�ͨ�������ž�װ���еĿ��� Cl2��H2O=HCl��HClO��HCl��AgNO3=AgCl����HNO3 ���ҷ�Ӧ�������ػ�ɫ���� Cu��Cl2![]() CuCl2 ��ֹ�Ҳ��Թ��е�ˮ������Ӳ�ʲ������У�ʹӲ�ʲ�����ը�� �ȱ�����ɫ ����β���е���������ֹ��Ⱦ���� Cl2��2NaOH=NaCl��NaClO��H2O dz����ɫ ��
CuCl2 ��ֹ�Ҳ��Թ��е�ˮ������Ӳ�ʲ������У�ʹӲ�ʲ�����ը�� �ȱ�����ɫ ����β���е���������ֹ��Ⱦ���� Cl2��2NaOH=NaCl��NaClO��H2O dz����ɫ ��
��������
ͨ�������������Ⱥ���ͭ��Ӧ�����Ȼ�ͭ��Ӳ�ʲ������еķ�Ӧ����Ϊ�����ҷ�Ӧ�������ػ�ɫ���̣��Ȼ�ͭ����ˮ����ˮ���գ�ĩ��Ӧ��������ˮ��Ӧ����ˮ������������Ư���ԣ��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ�ȱ�����ɫ����ˮ�к��������ӣ���AgNO3��Һ��Ӧ���ɰ�ɫ�����������ж���β��������������Һ��������ֹ��Ⱦ������
��1��Ϊ��ֹͭ������е�������Ӧ���ڼ���֮ǰӦ�ý��еIJ���Ϊͨ�������ž�װ���еĿ�����
��2��������ˮ��Ӧ��������ʹ����ᣬ���۲쵽AgNO3��Һ�г��ְ�ɫ����ʱ����ȼ�ƾ��Ƽ��ȣ�AgNO3��Һ�з�����Ӧ�Ļ�ѧ����ʽ��Cl2��H2O=HCl��HClO��HCl��AgNO3=AgCl����HNO3 ��
��3��ͭ���������Ⱥ�����Ӧ�����Ȼ�ͭ��Ӳ�ʲ������еķ�Ӧ����Ϊ���ҷ�Ӧ�������ػ�ɫ���̣���Ӧ�Ļ�ѧ����ʽΪCu��Cl2![]() CuCl2 ��
CuCl2 ��
��4��װ���п��Թܵ������Ƿ�ֹ�Ҳ��Թ��е�ˮ������Ӳ�ʲ������У�ʹӲ�ʲ�����ը�ѡ�
��5����ˮ������������Ư���ԣ�ʵ���У��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ�ȱ�����ɫ��
��6�������ж����ձ�������������Һ������������β���е���������ֹ��Ⱦ������������Ӧ�Ļ�ѧ����ʽΪCl2��2NaOH=NaCl��NaClO��H2O��
��7��ʢˮ���Թ��У���Һ������ɫΪdz����ɫ��˵������������ˮ��

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д� ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�