题目内容
【题目】根据能量变化示意图,下列说法正确的是
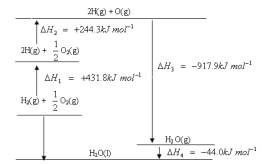
A. H2在O2中燃烧生成气态水的过程中吸收能量
B. 断开1mol H2O(g)所含的共价键共放出917.9kJ的能量
C. H2O(g)比H2O(l)更稳定
D. H2在O2中燃烧生成液态水的热化学方程式为:2H2(g) + O2(g) == 2H2O(l) ![]() H = -571.6 kJ·mol-1
H = -571.6 kJ·mol-1
【答案】D
【解析】
A.反应物的总能量高于生成物的总能量,说明该反应过程放出热量;
B.断开1mol H2O(g)所含的共价键需要吸收能量,而不是放热;
C.能量越低越稳定;
D.根据盖斯定律计算反应热即可,注意反应热的正负号。
A. H2在O2中燃烧生成气态水,从上述图像可以看出,H2(g)+![]() O2(g)的能量大于H2O(g)的能量,因此此反应放出热量,故A项错误;
O2(g)的能量大于H2O(g)的能量,因此此反应放出热量,故A项错误;
B. 断开1mol H2O(g)所含的共价键需要吸收能量,故B项错误;
C. 从图像可以得出,H2O(l)比H2O(g)的能量低,H2O(l)更稳定,故C项错误;
D.根据图像可得,2H2(g) + O2(g) =2H2O(l) ![]() H =2×(△H1+△H2+△H3+△H4)= -571.6 kJ·mol-1,故D项正确;
H =2×(△H1+△H2+△H3+△H4)= -571.6 kJ·mol-1,故D项正确;
答案选D。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作 | 反应或现象 | 结论 |
(1)取少量除尽 Cu2+后的溶液于试管中,加入__溶液,振荡 | 现象____ | 存在 Fe3+ |
(2)取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡 | 离子方程式____ | 存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。


(1)装置B 的作用是_______ 。
(2)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。_________
(3)下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为___________ ,继续高温至1000℃生成_______(填化学式)固体。
 。
。
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色变深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略体积变化。
A. 实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B. 实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C. 实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D. 实验④,可证明升高温度,Fe3+水解平衡正向移动
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D







