题目内容
【题目】被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: 
(1)写出氢氧燃料电池工作时负极反应方程式: .
(2)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O反应生成 H2 和 CO 的化学方程式: .
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
电池总离子反应方程式为
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、O 三种元素,常用作有机合成的中间体.16.8g 该有机物经燃烧生成 44.0g CO2 和 14.4g H2O;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O﹣H 键和位于分子端的﹣C≡C﹣键,核磁共振氢谱有三个峰,峰面积为 6:1:1.A 的分子式是 . A的结构简式是 .
【答案】
(1)2H2+4OH﹣﹣4e﹣═4H2O
(2)C3H8+3H2O ![]() 3CO+7H2
3CO+7H2
(3)CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;CH4+2O2+2OH﹣═CO32﹣+3H2O
(4)C5H8O;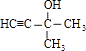
【解析】解:(1)氢氧燃料电池中,电解质溶液为碱,则负极上氢气得电子生成水,则其电极反应式为:2H2+4OH﹣﹣4e﹣═4H2O,所以答案是:2H2+4OH﹣﹣4e﹣═4H2O;(2)丙烷和 H2O反应生成 H2 和 CO,反应的化学方程式为C3H8+3H2O ![]() 3CO+7H2 , 所以答案是:C3H8+3H2O
3CO+7H2 , 所以答案是:C3H8+3H2O ![]() 3CO+7H2;(3)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;碱性条件下,甲烷燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,则总反应方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,
3CO+7H2;(3)燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;碱性条件下,甲烷燃烧生成的二氧化碳再与氢氧根离子结合生成碳酸根离子,则总反应方程式为CH4+2O2+2OH﹣═CO32﹣+3H2O,
所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O;CH4+2O2+2OH﹣═CO32﹣+3H2O;(4)有机物A只含有C、H、O三种元素,质谱图表明其相对分子质量为84,16.8g有机物A的物质的量为0.2mol,经燃烧生成44.0g CO2 , 物质的量为1mol,生成14.4g H2O,物质的量为 ![]() =0.8mol,故有机物A中C原子数目为
=0.8mol,故有机物A中C原子数目为 ![]() =5,H原子数目为
=5,H原子数目为 ![]() =8,故氧原子数目为
=8,故氧原子数目为 ![]() =1,故A的分子式为C5H8O,
=1,故A的分子式为C5H8O,
不饱和度为 ![]() =2,红外光谱分析表明A分子中含有O﹣H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个﹣OH连接在同一C原子上,故A的结构简式为
=2,红外光谱分析表明A分子中含有O﹣H键和位于分子端的C≡C键,核磁共振氢谱有三个峰,峰面积为6:1:1,故分子中含有2个CH3、1个﹣OH连接在同一C原子上,故A的结构简式为 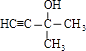 ,
,
所以答案是:C5H8O; 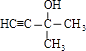 .
.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案


