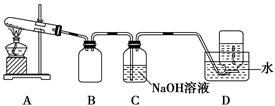
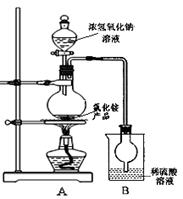
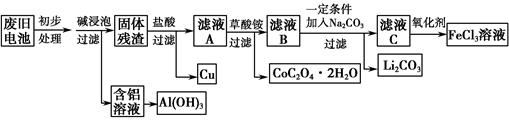
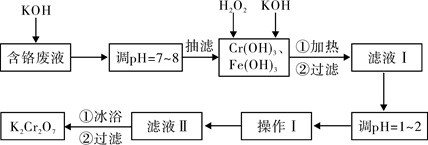
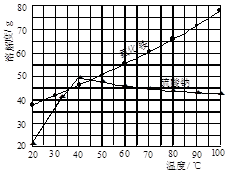题目内容
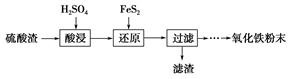
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、SO42—和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下:
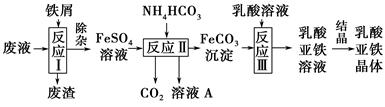
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+??2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)??Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。

(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+??2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)??Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。
(1)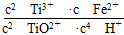
(2)防止NH4HCO3分解(或减少Fe2+的水解)
FeSO4+2NH4HCO3=FeCO3↓+H2O+CO2↑+(NH4)2SO4 取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水或H2O2,溶液呈血红色,证明有Fe2+,反之,不含有Fe2+
(3)CO32—与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
(4)有利于水的蒸发、防止Fe2+被氧化
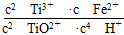
(2)防止NH4HCO3分解(或减少Fe2+的水解)
FeSO4+2NH4HCO3=FeCO3↓+H2O+CO2↑+(NH4)2SO4 取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水或H2O2,溶液呈血红色,证明有Fe2+,反之,不含有Fe2+
(3)CO32—与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
(4)有利于水的蒸发、防止Fe2+被氧化
(1)由反应关系可写出反应2TiO2++Fe+4H+ 2Ti3++Fe2++2H2O的平衡常数表达式为
2Ti3++Fe2++2H2O的平衡常数表达式为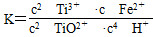 。(2)反应Ⅱ需要控制反应温度低于35 ℃的目的是防止碳酸氢铵分解,减少Fe2+的水解,由反应物和主要产物可写出反应Ⅱ的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O;检验溶液中是否有Fe2+可以先加硫氰化物溶液,然后加合适的氧化剂,看溶液是否变为血红色。(3)碳酸亚铁溶液中存在沉淀溶解平衡,其中的CO32—和乳酸反应,使碳酸亚铁的溶解平衡向溶解方向移动,生成乳酸亚铁。(4)由于Fe2+易被氧化,真空可以防止Fe2+被氧化,同时有利于水分蒸发有利于晶体结晶。
。(2)反应Ⅱ需要控制反应温度低于35 ℃的目的是防止碳酸氢铵分解,减少Fe2+的水解,由反应物和主要产物可写出反应Ⅱ的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O;检验溶液中是否有Fe2+可以先加硫氰化物溶液,然后加合适的氧化剂,看溶液是否变为血红色。(3)碳酸亚铁溶液中存在沉淀溶解平衡,其中的CO32—和乳酸反应,使碳酸亚铁的溶解平衡向溶解方向移动,生成乳酸亚铁。(4)由于Fe2+易被氧化,真空可以防止Fe2+被氧化,同时有利于水分蒸发有利于晶体结晶。
 2Ti3++Fe2++2H2O的平衡常数表达式为
2Ti3++Fe2++2H2O的平衡常数表达式为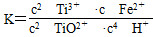 。(2)反应Ⅱ需要控制反应温度低于35 ℃的目的是防止碳酸氢铵分解,减少Fe2+的水解,由反应物和主要产物可写出反应Ⅱ的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O;检验溶液中是否有Fe2+可以先加硫氰化物溶液,然后加合适的氧化剂,看溶液是否变为血红色。(3)碳酸亚铁溶液中存在沉淀溶解平衡,其中的CO32—和乳酸反应,使碳酸亚铁的溶解平衡向溶解方向移动,生成乳酸亚铁。(4)由于Fe2+易被氧化,真空可以防止Fe2+被氧化,同时有利于水分蒸发有利于晶体结晶。
。(2)反应Ⅱ需要控制反应温度低于35 ℃的目的是防止碳酸氢铵分解,减少Fe2+的水解,由反应物和主要产物可写出反应Ⅱ的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O;检验溶液中是否有Fe2+可以先加硫氰化物溶液,然后加合适的氧化剂,看溶液是否变为血红色。(3)碳酸亚铁溶液中存在沉淀溶解平衡,其中的CO32—和乳酸反应,使碳酸亚铁的溶解平衡向溶解方向移动,生成乳酸亚铁。(4)由于Fe2+易被氧化,真空可以防止Fe2+被氧化,同时有利于水分蒸发有利于晶体结晶。
练习册系列答案
相关题目