题目内容
放射性同位素 的原子核内中子数与电子数之差是
的原子核内中子数与电子数之差是
| A.32 | B.67 | C.99 | D.166 |
A
解析试题分析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。又因为质子数+中字数=质量数,质子数=核外电子数,所以放射性同位素 的原子核内中子数与电子数之差=166-67-67=32,答案选A。
的原子核内中子数与电子数之差=166-67-67=32,答案选A。
考点:考查原子组成以及组成原子微粒之间数量关系的计算

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
下列叙述正确的是
| A.同种元素的原子均具有相同的质子数和中子数 |
| B.不同元素的原子构成的分子只含极性键 |
| C.第三周期中的非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
| D.第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |
下列各组顺序的排列错误的是
| A.金属性:Na<Mg<Al | B.热稳定性:HCl>H2S>PH3 |
| C.酸性强弱:H4SiO4<H2CO3<HNO3 | D.熔点:金刚石>食盐>干冰 |
下列分子中所有原子都满足最外层为8个电子结构的是
| A.BF3 | B.H2O | C.SiCl4 | D.PCl5 |
在一定条件下,含短周期元素R的离子RO3n-与R2-发生如下反应:RO3n- +2R2- +6H+=3R+3H2O,下列关于元素R的叙述中正确的是
| A.R原子的最外层上有4个电子 | B.RO3n-中的R只能被还原 |
| C.R的最外层电子排布式是nsnnp2n | D.HnRO4一定是强酸 |
短周期元素W、X、Y和Z的原子序数依次增大。其中W的原子半径最小,X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,且Y和Z可以形成化合物ZY2和ZY3。根据以上叙述,下列说法中正确的是
| A.以上四种元素的原子半径大小为W<X<Y<Z |
| B.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| C.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列说法正确的是( )
| A.电子云就是电子运动的形态 |
| B.焰色反应产生的是发射光谱 |
| C.铜原子处于基态时的核外电子排布式为3d104s1 |
| D.核外电子运动状态可以用牛顿运动定律来描述,也可以用统计方法来描述 |
下列判断错误的是
A.沸点: |
B.熔点: |
C.酸性: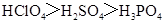 |
D.碱性: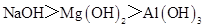 |