题目内容
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
D
解析试题分析:离子化合物Z2Y中Z的化合价为+1价,Y的化合价为-2价,分别为ⅠA族和ⅥA族元素。已知Y、R同主族,且形成共价化合物RY3,则R为S元素,Y为O元素。Z、R、W同周期,则Z为Na元素,X、Y、Z、R、W是5种短周期元素,原子序数依次增大,则W是Cl元素,根据XW4可知X为C元素。A、同周期元素从左到右原子半径逐渐减小,Z、R、W同周期,分别为Na、S、Cl,原子序数逐渐增大,则原子半径逐渐减小,故A正确;B、X2W6分子为C2Cl6,每个C原子形成4个共价键,C原子最外层满足8电子稳定结构,Cl形成1个共价键,最外层电子数也为8,故B正确;C、HmY为H2O,含有氢键,沸点较高,所以气态氢化物沸点:HmY>HnR,故C正确;D、Y、Z两种元素组成的化合物有Na2O、Na2O2等,其中过氧化钠中还含有非极性键,故D错误,答案选D。
考点:考查元素周期表的结构以及元素周期律的应用

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
元素周期表中铋元素的数据见图,下列说法正确的是( )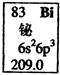
| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层(能级)有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |
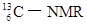 (核磁共振)可以用于含碳化合物的结构分析,有关
(核磁共振)可以用于含碳化合物的结构分析,有关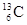 的说法正确的是( )
的说法正确的是( )
| A.质子数为6 | B.电子数为13 | C.中子数为6 | D.质量数为6 |
下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
下列叙述正确的是( )
| A.同一主族的元素,原子半径越大,其单质的熔点一定越高 |
| B.同一周期元素的原子,半径越小越容易失去电子 |
| C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 |
| D.稀有气体元素的原子序数越大,其单质的沸点一定越高 |
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素且X常见化合价+1和—1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述正确的是
A.原子半径的大小顺序: |
| B.元素Y的简单气态氢化物的热稳定性比W的弱 |
| C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性 |
放射性同位素 的原子核内中子数与电子数之差是
的原子核内中子数与电子数之差是
| A.32 | B.67 | C.99 | D.166 |
下列说法正确的是
| A.原子最外层电子数为2的元素一定处于周期表IIA族 |
| B.原子序数相差2的两元素不可能处于同一主族 |
| C.可根据氢化物的稳定性和酸性强弱,来判断非金属元素得电子能力强弱 |
| D.非金属元素的最高化合价不超过其元素电子的最外层电子数 |