��Ŀ����
����Ŀ����ͼ��ʾ��p��qΪֱ����Դ��������A�ɽ�������X�Ƴɣ�B��C��DΪ���缫����ͨ��Դ������X������B����ͬʱC��D�ϲ������ݣ��Իش� 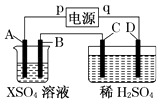
��1��pΪ����A����������Ӧ��
��2��CΪ�������ռ�����DΪ�������ռ��� ��
��3��C���ĵ缫��ӦʽΪ ��
��4���ڵ������У���C��D�����ϲ�������������ʵ�����������
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
������������������cm3�� | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
������������������cm3�� | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
��ϸ��������ʵ�����ݣ���˵���仯�Ŀ���ԭ���� ��
��5������Ӧ����һ��ʱ���A��B�缫������Һ��pH���������С�����䡱����
��6������·��ͨ��0.004mol����ʱ��B���ϳ����Ľ���XΪ0.128g����˽�����Ħ������Ϊ ��
���𰸡�
��1����������
��2��������������������
��3��4OH����4e��=O2��+2H2O
��4����ʼʱC��D�������������Ϊ1��3,10����ʱԼΪ1��2,˵����ʼʱ�����ܽ�����Һ��
��5������
��6��64g/mol
���������⣺��1����ͨ��Դ������X������B����ͬʱC��D�������ݣ���BΪ������X�����������ŵ����ɽ������ʣ���A��C��������B��D������������p��������A�缫��ʧ���ӷ���������Ӧ��
���Դ��ǣ�������������2��C�缫�ǵ������������������������ӷŵ磻DΪ���������ӷŵ��������������Դ��ǣ�����������������������3��C�����������������������ӷŵ������������缫��ӦʽΪ��4OH����4e��=O2��+2H2O��
���Դ��ǣ�4OH����4e��=O2��+2H2O����4��������������������ˮ������������������ˮ������1��6�����������������ܽ�Ŀ���࣬�Ӷ������������������ɵ��������֮�ȴ���2��1��
���Դ��ǣ���ʼʱC��D�������������Ϊ1��3��10����ʱԼΪ1��2��˵����ʼʱ�����ܽ�����Һ�У���5�����������Һʵ���ϵ�����ˮ�����һ��ʱ���A��B�缫������Һ��pH���䣬���Դ��ǣ����䣻��6������Ħ������ΪM�����ʱ��B�缫�ϵĵ缫��ӦʽΪX 2++2e��=X����
X2++ | 2e��= | X |
2mol | 1mol | |
0.004mol |
|
M= ![]() =64g/mol��
=64g/mol��
���Դ��ǣ�64g/mol��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����壮
��1��4CO��g��+2NO2��g���T4CO2��g��+N2��g����H=��1 200kJmol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ��T2��T1��������������ͬʱ������ͼ����ȷ����������ţ���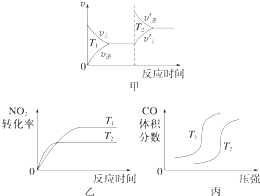
��2������β����CO��H2O��g����һ�������¿��Է�����Ӧ��
CO��g��+H2O��g��CO2��g��+H2��g����H��0��
820��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����±�����Ͷ�ϣ��ﵽƽ��״̬��K=1.0��
��ʼ���ʵ��� | �� | �� | �� |
n��H2O��/mol | 0.10 | 0.20 | 0.20 |
n��CO��/mol | 0.10 | 0.10 | 0.20 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��ƽ��ʱ����������CO��ת������ �� �Ƚ�����������CO��ת���ʣ����ף����ף����������=����������
�۱������У�ͨ���ı��¶ȣ�ʹCO��ƽ��ת�����������¶�������ߡ����͡�����ƽ�ⳣ��K�����������С�����䡱����
����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±�����ش�
ʵ���� | HA���ʵ���Ũ�� | NaOH���ʵ���Ũ�� | �����Һ��pH |
�� | 0.2 | 0.2 | pH=a |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH��7 |
�� | 0.1 | 0.1 | pH=9 |
��1���������������ʵ���������Ӽ�����������������a �������Һ��pH����˵��HA��ǿ�ỹ������ ��
��2���������������ʵ�����������������������C�Ƿ�һ������0.2��ѡ��ǡ��������Һ������Ũ��c��A������ c��Na+���Ĵ�С��ϵ�� ��
��3������ʵ����������HA���ᣨѡ�ǿ�������������û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c��OH����=molL��1 �� д���û����Һ��������ʽ�ľ�ȷ��������������Ƽ��㣩��c��Na+����c��A����=molL��1 c��OH������c��HA��=molL��1 ��






