题目内容
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
【答案】
(1)a=7为强酸,a>7为弱酸
(2)否; c(A﹣)=c(Na+)
(3)弱; c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
(4)10﹣5;10﹣5﹣10﹣9;10﹣9
【解析】解:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
所以答案是:a=7为强酸,a>7为弱酸;(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,
由于反应后溶液呈中性,则有c(OH﹣)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A﹣)+c(OH﹣),
所以c(A﹣)=c(Na+),所以答案是:否;c(A﹣)=c(Na+);(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A﹣+H2OHA+OH﹣,则
c(Na+)>c(A﹣),溶液呈碱性,则c(OH﹣)>c(H+),一般来说,盐类的水解程度较低,则有c(A﹣)>c(OH﹣),所以有:c(Na+)>c(A﹣)>c(OH﹣)>c(H+),
所以答案是:弱;c(Na+)>c(A﹣)>c(OH﹣)>c(H+);(4)溶液的pH=9,则氢离子浓度为10﹣9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH﹣)= ![]() =
= ![]() =10﹣5 mol/L,
=10﹣5 mol/L,
一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(A﹣),
依据上述计算得到:c(Na+)﹣c(A﹣)=c(OH﹣)﹣c(H+)=10﹣5﹣10﹣9;
依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH﹣)+c(A﹣),c(Na+)=c(A﹣)+c(HA),合并得到c(OH﹣)﹣c(HA)=c(H+)=10﹣9 ,
所以答案是:10﹣5;10﹣5﹣10﹣9;10﹣9.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 黄冈小状元同步计算天天练系列答案
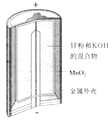
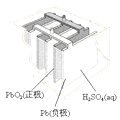
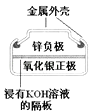
黄冈小状元同步计算天天练系列答案【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 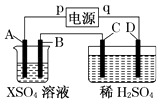
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .