题目内容
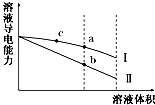
【题目】常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。

(1)写出单质X的结构式是________________________________________________;
(2)化合物甲的电子式是_____________________________;其水溶液呈________ 性。
(3)化合物丙中存在的化学键是____________________________________________。
【答案】 N≡N 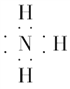 碱 离子键、共价键
碱 离子键、共价键
【解析】常温下由三种短周期元素形成的气体单质X、Y、Z,X分子中含共价键最多,则X应为氮气;单质X与单质Y形成共价化合物甲,甲分子中含10个电子,所以甲为氨气,Y为氢气;单质Y与单质Z形成共价化合物乙,乙分子含有18个电子,则Z为氯气,乙为氯化氢;氯化氢和氨气反应生成氯化铵,则丙为氯化铵。
(1)单质X为N2,氮原子最外层5个电子,两个氮原子共用3对电子达到8电子稳定结构,故N2的结构式为:N≡N。
(2)甲为氨气,分子式为NH3,1个氮原子与3个氢原子通过共用电子形成共价化合物分子,氢原子达到2电子稳定结构、氮原子达到8电子稳定结构,电子式为:![]() ;氨气溶于水,氨分子与水反应生成NH3H2O是一种弱碱,故氨水溶液呈碱性。
;氨气溶于水,氨分子与水反应生成NH3H2O是一种弱碱,故氨水溶液呈碱性。
(3)丙为氯化铵,化学式为NH4Cl,NH4Cl中NH4+与Cl-之间存在离子键,NH4+中N原子和H原子间存在共价键,故NH4Cl中存在的化学键有离子键和共价键。

【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 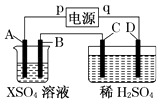
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .