题目内容
如下图所示装置,请回答下列问题:
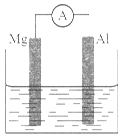
(1)若烧杯中溶液为稀硫酸,则观察到的现象为__________________。
两极反应式为:正极_______________________________;
负极_______________________________。
该装置将_________能转化为_________能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________,电子流向:__ _______________总反应方程为____________________________。

(1)若烧杯中溶液为稀硫酸,则观察到的现象为__________________。
两极反应式为:正极_______________________________;
负极_______________________________。
该装置将_________能转化为_________能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________,电子流向:__ _______________总反应方程为____________________________。
(1)Al棒上有气泡产生 2H++2e-=H2↑ Mg-2e-=Mg2+ 化学 电
(2)Al 由Al到Mg; 2Al+2OH-+2H2O=2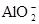 +3H2↑
+3H2↑
(2)Al 由Al到Mg; 2Al+2OH-+2H2O=2
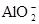 +3H2↑
+3H2↑试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。
(1)镁比铝活泼,是镁是负极,铝是正极,所以Al棒上有气泡产生。电极反应式分别是正极:2H++2e-=H2↑,负极:Mg-2e-=Mg2+。
(2)由于镁和氢氧化钠溶液不反应,但铝可以,所以此时铝是负极,镁是正极,因此电子由Al到Mg,总反应的离子方程式是2Al+2OH-+2H2O=2
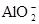 +3H2↑。
+3H2↑。点评:该题是基础性试题的考查,试题注重方法和能力的考查,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确原电池的工作原理,并能灵活运用即可。

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目