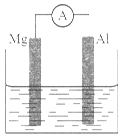
题目内容
现有如下两个反应:
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池:A、 , B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因
________________________________________________________________;
(3)如果可以,则写出正、负极材料、电极反应式及电解质溶液名称:
负极材料________,电极反应式为 ,正极材料 ,电极反应式为 ,
电解质溶液名称是 。
A、NaOH + HCl =" NaCl" + H2O
B、2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池:A、 , B、__________(选择“能”或“不能”);
(2)如果不能,说明其原因
________________________________________________________________;
(3)如果可以,则写出正、负极材料、电极反应式及电解质溶液名称:
负极材料________,电极反应式为 ,正极材料 ,电极反应式为 ,
电解质溶液名称是 。
(1)(A)不能 (B)能 (2)(A)的反应为非氧化还原反应,没有电子转移
(3) 负极:铜,Cu-2e- =Cu2+,正极:碳棒,2Fe3+ +2e- = 2Fe2+ :氯化铁溶液
(3) 负极:铜,Cu-2e- =Cu2+,正极:碳棒,2Fe3+ +2e- = 2Fe2+ :氯化铁溶液
试题分析:(1)氧化还原反应中有电子的转移,所以只有氧化还原反应才能设计成原电池。A不是氧化还原反应,不能设计成原电池。B是氧化还原反应,可以设计成原电池。
(2)见(1)中的分析
(3)根据方程式可知,铜是还原剂失去电子。氯化铁是氧化剂,铁离子得到电子,所以根据原电池的工作原理可知,负极材料应该是铜,电极反应式是Cu-2e- =Cu2+。正极材料可以是金属性弱于铜的金属,也可以是能够导电的非金属,例如碳棒,电极反应式是2Fe3+ +2e- = 2Fe2+ 。而根据方程式可知电解质溶液应该是氯化铁溶液。
点评:该题是中等难度的试题,试题难易适中,注重基础知识的考查,侧重能力的培养和解题方法的指导,有利于培养学生的逻辑思维能力和创新思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的工作原理。

练习册系列答案
相关题目
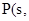 白磷
白磷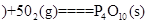 △H=-2983.2KJ/mol
△H=-2983.2KJ/mol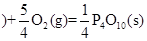 △H=-738.5KJ/mol
△H=-738.5KJ/mol