题目内容
如下两个反应: A、NaOH+HCl=NaCl+H2O B、2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。其理由_________________________________________________________。
(2)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子的流动方向,写出电极反应式。


________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。其理由_________________________________________________________。
(2)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子的流动方向,写出电极反应式。


________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。
(1)(A)不行(B)可以,(A)不是氧化还原反应,没有发生电子的转移
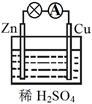
(2)实验装置图如右图所示:
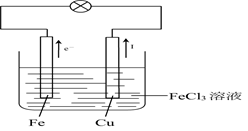
Cu(或C)是正极,正极反应式:2Fe3++2e-=2Fe2+
Fe是负极,负极反应式:Fe-2e-=Fe2+
(2)实验装置图如右图所示:

Cu(或C)是正极,正极反应式:2Fe3++2e-=2Fe2+
Fe是负极,负极反应式:Fe-2e-=Fe2+
试题分析:判断能否设计原电池的原理是该反应能否发生氧化还原反应,有无电子转移,依题意可知A不行,B有电子转移,故可以。
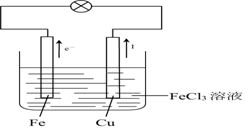

依据不活泼物质如Cu或C做正极Cu(或C)是正极,正极反应式:2Fe3++2e-=2Fe2+
活泼的金属如Fe容易失去电子做负极,负极反应式:Fe-2e-=Fe2+
点评:原电池是高中化学的重点也是难点,考生要着重掌握原电池设计原理,从本质上去理解从而真正地掌握,培养发散思维能力。

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目

 H2↑
H2↑