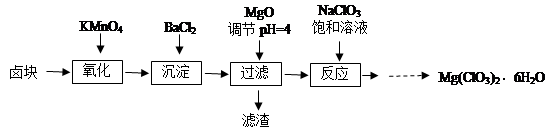题目内容
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为 。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论: 。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:
称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为 。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式 。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因: 。
(1)氢气(或H2)(2分)
(2)Mg(OH)2(2分)取少许实验①固体,加足量稀盐酸,若有气泡产生,则含有MgCO3。反之,则无。(2分)
(4)2Mg(OH)2?3MgCO3或Mg5(OH)4(CO3)3 (2分)
(5)5Mg+6NaHCO3+4H2O= 2Mg(OH)2? 3MgCO3↓+3Na2CO3+5H2↑(2分)
(6)Mg和H+反应生成H2和Mg2+,Mg2+跟OH-、CO32-结合生成沉淀,则H+、OH-、CO32-的浓度均降低,上述平衡均向右移动。所以Mg和饱和NaHCO3溶液反应产生大量气体和白色不溶物。(3分)
解析试题分析:(1)将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变可分析出是氢气。
(2)根据元素守恒和物质的溶解性可知:白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2与MgCO3,故猜测1为Mg(OH)2;根据碳酸盐的性质,能与强酸反应生成CO2气体,所以检验是否含有MgCO3的方法为:取少许实验①固体,加足量稀盐酸,若有气泡产生,则含有MgCO3。反之,则无。
(4)B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为2.64g,设含MgCO3的质量为x,则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 2.64g
可得:84:44=x:2.64g,解得x=5.04g,所以含Mg(OH)2的质量为:7.36g—5.04g=2.32g,Mg(OH)2与MgCO3的物质的量之比为:2.32g÷58g/mol:(5.04g÷84g/mol)=0.4mol:0.6mol=2:3,所以白色不溶物的化学式为:2Mg(OH)2?3MgCO3或Mg5(OH)4(CO3)3
(5)根据上述探究实验可知,镁与饱和碳酸氢钠溶液反应,生成了2Mg(OH)2?3MgCO3和H2,根据元素守,恒,还会生成Na2CO3,所以化学方程式为:5Mg+6NaHCO3+4H2O = 2Mg(OH)2? 3MgCO3↓+3Na2CO3+5H2↑。
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,镁是活泼金属,能与H+反应,生成Mg2+和H2,Mg2+能与OH?结合成Mg(OH)2沉淀,Mg2+还能与CO32?结合成MgCO3沉淀,H+、OH-、CO32-的浓度均降低,上述平衡均向右移动。所以Mg和饱和NaHCO3溶液反应产生大量气体和白色不溶物。
H+ +CO32-,镁是活泼金属,能与H+反应,生成Mg2+和H2,Mg2+能与OH?结合成Mg(OH)2沉淀,Mg2+还能与CO32?结合成MgCO3沉淀,H+、OH-、CO32-的浓度均降低,上述平衡均向右移动。所以Mg和饱和NaHCO3溶液反应产生大量气体和白色不溶物。
考点:本题考查探究实验的分析、物质的判断、化学计算、化学方程式的书写、平衡移动。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案某研究性学习小组对还原铁粉与水蒸气的反应产物进行科学探究。已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃:根据下图所示实验装置,进行了还原铁粉与水蒸气的反应实验,实验中观察到肥皂液中产生了大量的气泡。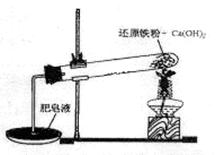
(1)实验中Ca(OH)2的作用是 。实验中产生的气体产物是 。
(2)为进一步探究还原铁粉与水蒸气反应固体产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体,针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:固体为Fe3O4
假设三:
①限选用下列试剂:盐酸、KSCN溶液、K3Fe(CN)6 溶液、氯水,证明假设一不成立
| 操作 | 现象 | 结论 |
| | | 假设一不成立 |
②为了进一步确定产物的成分,用黑色固体进行了下列实验:

加入足量氯水所发生反应的离子方程式是 ;检验红褐色固体是否洗涤干净的操作是 ;灼烧时盛放固体的仪器是 ;若假设二成立,黑色固体最终全部转化成的红棕色粉末的质量是 g
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应: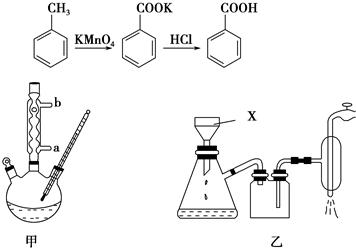
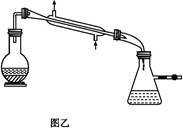
(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
洗涤苯甲酸晶体时应用________洗涤。



 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。