题目内容
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出Fe的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。其原因是__________,将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
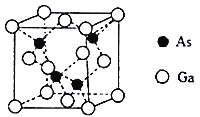
(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。
【答案】[Ar]3d64s2 N>P>As NH3 氨气分子间存在氢键 NO43- sp 6 共价键、配位键 N 氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子 正四面体 ![]()
【解析】
(1)Fe的原子序数为26,由构造原理可知电子排布为1s22s22p63s23p63d64s2或[Ar]3d64s2;
故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(2)同一主族元素,元素的电负性随着原子序数增大而减小,所以电负性大小顺序是N>P>As;含有氢键的氢化物熔沸点较高,氢化物中不含氢键时,相对分子质量越大的熔沸点越高,这三种元素的氢化物中只有氨气含有氢键,所以氨气的熔沸点最高;根据等电子体知识可知,与SO42-互为等电子体的阴离子的化学式为NO43-;
故答案为:N>P>As;NH3;氨气分子间存在氢键;NO43-;
(3)①配体CN中碳原子价层电子对个数是2且含有一个孤电子对,根据价层电子对互斥理论判断C原子杂化类型为sp,故答案为:sp;
②[Co(N3)(NH3)5]SO4中Co的配体是NH3和N3,所以Co原子配位数是6,非金属元素之间存在共价键,含有孤电子对和含有空轨道的原子之间存在配位键,所以该配离子中含有共价键和配位键;原子轨道上电子处于全满、全空、半满时最稳定,氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子,所以这三种元素第一电离能最大的是N元素;故答案为:6;共价键、配位键;N;氮原子2p轨道上的电子为半充满,相对稳定,更不易失去电子;
(4)晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体结构;该晶胞中As原子个数是4、Ga原子个数![]() ,其密度
,其密度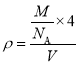 ,则
,则![]() ;
;
故答案为:正四面体;![]() 。
。