题目内容
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为 ,Y的简单氢化物分子式为 。
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为________。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。

①甲的化学式为______________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离U+ 最近的Z2- 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是________________cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
(1)U单质的原子堆积方式为 ,Y的简单氢化物分子式为 。
(2)X的一种氢化物的相对分子质量为28,其分子中σ键与π键的键数之比为________。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。

①甲的化学式为______________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离U+ 最近的Z2- 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是________________cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
(1)体心立方堆积 ; NH3; (2)5∶1;
(3)①KO2 ; ②BC ; ③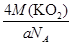 (或
(或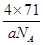 或
或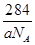 )
)
(3)①KO2 ; ②BC ; ③
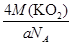 (或
(或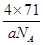 或
或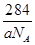 )
)试题分析:X、Y、Z、U为原子序数依次增大的前四周期元素,基态Y原子的2p轨道处于半充满状态,则外围排布为2s22p3,因此Y为氮元素;X、Y、Z三种元素位于同一周期,且XZ2与Y2Z互为等电子体,因此符合条件的化合物只能是CO2与N2O,故X为碳元素、Z为氧元素;含U的化合物的焰色为紫色,则U为钾元素。
(1)U为钾元素,K单质的原子堆积方式为体心立方堆积;N元素的简单氢化物分子式为NH3。
(2)X为碳元素,一种氢化物的相对分子质量为28,则该氢化物为C2H4,分子中含有1个碳碳双键、4个C-H。碳碳双键含有1个σ键、1个π键,单键都为σ键,因此C2H4分子中σ键与π键的键数之比为5:1。
(3)化合物甲由Z、U两元素组成,其晶胞如图所示。
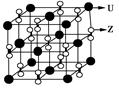
①由晶胞结构并依据均摊法可知,晶胞中K原子数目=8×
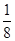 +6×
+6×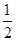 =4。O原子数目=2×12×
=4。O原子数目=2×12×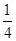 +2=8,故K原子与O原子数目之比为4:8=1:2,所以甲的化学式为KO2。
+2=8,故K原子与O原子数目之比为4:8=1:2,所以甲的化学式为KO2。②A、由①中计算可知,每个晶胞中含有4个K+和4O2-,故A错误;B、由晶胞结构可知,晶体中每个K+周围距离K+最近的O2-有6个(即上下、左右和前后个1个),故B正确;C、该晶体由K+和O2-构成,属于离子晶体,故C正确,答案选BC。
③晶胞含有4个钾离子,则晶胞的质量=
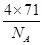 g,因为甲的密度为a g?cm-3,所以晶胞的体积=
g,因为甲的密度为a g?cm-3,所以晶胞的体积=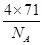 g÷ag?cm-3=
g÷ag?cm-3=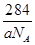 cm3。
cm3。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 =1.732)
=1.732)


 在过量氨水中易转化为
在过量氨水中易转化为 。写出
。写出 的价层电子排布图____。
的价层电子排布图____。 中
中 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中 键和
键和 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
 + N2↑ + 3CO2↑
+ N2↑ + 3CO2↑ 

