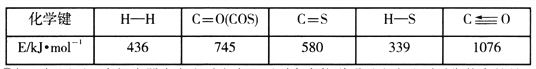
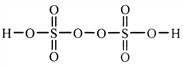
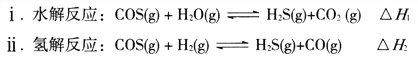题目内容
【题目】将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
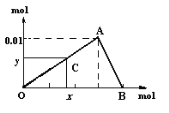
(1)OA曲线表示的离子反应是:__________________________;由此可得A点时加入氢氧化钠溶液的体积为____________;
(2)AB曲线表示的离子反应为:___________,由此可得B点的坐标为:_______。
(3)由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:____mol/L。
(4)当x=0.035时,铝元素在体系中的存在形式为________,其物质的量为____________。
【答案】Al3++3OH-=Al(OH)3↓ 10mL Al(OH)3+OH-=AlO2-+2H2O (0.04,0) 0.4 Al(OH)3、AlO2- 0.005mol、0.005mol
【解析】
根据图像,当从O点向A点运动时,表示随着氢氧化钠的不断加入,沉淀量逐渐增加,A点Al3+刚好完全沉淀,沉淀量达最大值;从A点到B点,随着氢氧化钠的不断加入,沉淀量逐渐减少,B点时Al(OH)3刚好完全溶解。根据原子守恒和相关方程式进行计算。
(1)当从O点向A点运动时,表示随着氢氧化钠的不断加入,沉淀量逐渐增加,因此OA曲线表示的离子反应是:Al3++3OH-=Al(OH)3↓。A点生成的氢氧化铝是0.01mol,则A点消耗的n(NaOH)=0.03mol,所以A点时加入氢氧化钠溶液的体积为为0.03mol÷3mol/L=0.01L=10mL。
(2)AB曲线表示Al(OH)3溶于NaOH,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。溶解0.01mol Al(OH)3消耗氢氧化钠0.01mol,由于之前已经消耗了0.03mol氢氧化钠,则B点的坐标为(0.04,0)。
(3)根据铝原子守恒可知n(AlCl3)=0.01mol,则c(AlCl3)=0.01mol÷0.025L=0.4mol/L,即AlCl3溶液中Al3+离子的浓度为0.4mol/L。
(4)当x=0.035时,加入氢氧化钠物质的量大于0.03mol(A点)小于0.04mol(B点),说明AlCl3完全沉淀后并溶解了部分Al(OH)3,铝元素在体系中的存在形式为Al(OH)3和AlO2-。加入0.03mol氢氧化钠时AlCl3完全沉淀生成0.01mol Al(OH)3沉淀,x=0.035mol时,溶解Al(OH)3消耗的氢氧化钠为0.035mol-0.03mol=0.005mol,根据离子反应Al(OH)3+OH-=AlO2-+2H2O可知0.005mol氢氧化钠溶解0.005mol Al(OH)3同时生成0.005molAlO2-,剩余的Al(OH)3为0.01mol-0.005mol=0.005mol;当x=0.035时,铝元素在体系中的存在形式为Al(OH)3和AlO2-,Al(OH)3和AlO2-物质的量都为0.005mol。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案