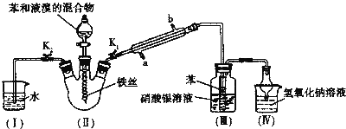
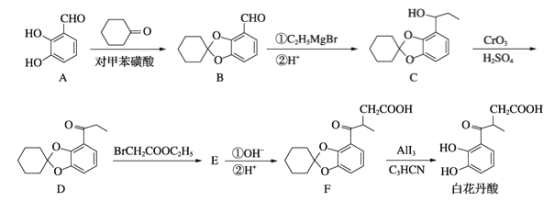
题目内容
【题目】电子在一个原子的下列能级的原子轨道中排布时,最后排布的是( )
A. ns B. np
C. (n-1)d D. (n-2)f
【答案】A
【解析】
根据基态原子核外电子排布的规律,电子应该依次进入ns轨道、(n-2)f轨道、(n-1)d轨道,最后进入np轨道,如果还有剩余电子则进入(n+1)s轨道。综上所述,A. n s不符合题意; B. n p符合题意;C. (n-1)d不符合题意; D. (n-2)f不符合题意;答案为B。

【题目】开发新型储氢材料是氢能源利用的重要研究方向之一。请回答以下问题:
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的电子排布式为____________________;LiBH4中Li、B、H元素的电负性由大到小的排列顺序为_________________。
②另有一种含钛元素的新型材料,其理论结构模型如图所示,图中虚线框内碳原子的杂化轨道类型为____________。

(2)氨硼烷(NH3BH3)是优良的储氢材料,少量氨硼烷可以由硼烷(B2H6)和NH3合成。
①NH3BH3中是否存在配位键__________(填“是”或“否”);与NH3BH3互为等电子体的分子的化学式为__________。
②B、C、N与O元素的第一电离能由大到小的顺序为___________________。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石。则立方氮化硼晶体可用作___________(选填下列字母序号)。
a.切削工具 b.钻探钻头 c.导电材料 d.耐磨材料
(3)一种有储氢功能的铜合金晶体具有面心立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。
①若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为________________;
②铜与其它许多金属及其化合物都可以发生焰色反应,其原因是_______________。
(4)金属氢化物也是具有良好发展前景的储氢材料。某储氢材料是短周期金属元素R的氢化物。R的部分电离能如下表所示:
I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
①该金属元素是___________(填元素符号)..
②若氢化物的晶胞结构如图所示(有4个H原子位于面上,其余H原子位于晶胞内),已知该晶体的密度为ρg·cm-3,则该晶胞的体积为__________cm3[用含ρ、NA的代数式表示(其中NA为阿伏加德罗常数的值)]。