题目内容
【题目】I.中国的侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程可以表示如图所示(![]() 代表所需物质,
代表所需物质,![]() 代表产品)
代表产品)

在上述工业流程中:
(1)产品N的化学式__________,所需物质A的名称____________,B的电子式____________。
(2)侯德榜制碱法的原理是_____________________________________(用化学方程式表示)。操作X的名称是_________________________。
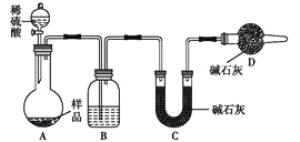
II.利用侯德榜原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。

实验步骤如下:
①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量(设为m1g);
③准确称取一定量的纯碱(设为ng),并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止;
⑤准确称取干燥管D的总质量(设为m2g)
根据上述实验,回答下列问题:
(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是__________________________。装置A中的液体应选用___________。
(4)装置B与D之间必须添加一装置C,否则使测定结果偏高。在空白框内画出该装置C,装置中盛放的是__________。
(5)根据此实验,计算出纯碱中Na2CO3的质量分数为_________________(用m1、m2、n表示)。如果缺少装置E,则实验所得纯碱样品的纯度会_________(“偏高”、“偏低”、或“无影响”)。
【答案】NH4Cl 氨气 ![]() NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl 过滤 确保CO2充分被吸收 氢氧化钠溶液
NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl 过滤 确保CO2充分被吸收 氢氧化钠溶液 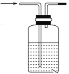 浓硫酸
浓硫酸 ![]() 偏高
偏高
【解析】
联合制碱法:以食盐、氨和二氧化碳为原料来制取纯碱,二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,A为NH3,B为CO2,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤、洗涤得NaHCO3微小晶体,再加热制得纯碱产品。
(1)产品N是氯化铵,化学式为NH4Cl,所需物质A的名称是氨气,CO2的电子式:![]() ;
;
(2)侯德榜制碱法的原理是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;操作X后得滤液和固体,则操作为过滤;
(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是确保CO2充分被吸收;为防止空气中的CO2造成实验误差,装置A中的液体应选用氢氧化钠溶液;
(4)装置B与D之间必须添加一装置C,吸收水分,否则使测定结果偏高;装置C为: ,装置中盛放的是浓硫酸;
,装置中盛放的是浓硫酸;
(5)根据此实验,干燥管D增加二氧化碳质量![]() g,通过差量法可知,纯碱中Na2CO3的质量分数为
g,通过差量法可知,纯碱中Na2CO3的质量分数为![]() ,如果缺少装置E,外界的二氧化碳、水蒸气会被干燥管D吸收,则实验所得纯碱样品的纯度会偏高。
,如果缺少装置E,外界的二氧化碳、水蒸气会被干燥管D吸收,则实验所得纯碱样品的纯度会偏高。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】测定不同温度下0.5 mol·L-1 CuSO4溶液和0.5 mol·L-1 Na2CO3溶液pH,数据如下表:
温度/℃ | 25 | 30 | 40 | 50 | 60 |
CuSO4(aq) pH | 3.71 | 3.51 | 3.44 | 3.25 | 3.14 |
Na2CO3(aq) pH | 10.41 | 10.30 | 10.28 | 10.25 | 10.18 |
下列说法不正确的是
A. 升高温度,Na2CO3溶液中c(OH-)增大
B. 升高温度,CuSO4溶液和Na2CO3溶液的水解平衡均正向移动
C. 升高温度,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 升高温度,可能导致CO32-结合H+程度大于H2O电离产生H+程度