题目内容
铝热法炼铁的化学方程式是:Fe2O3+2Al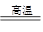 2Fe+Al2O3.这种金属冶炼的方法属于
2Fe+Al2O3.这种金属冶炼的方法属于
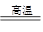 2Fe+Al2O3.这种金属冶炼的方法属于
2Fe+Al2O3.这种金属冶炼的方法属于| A.还原法 | B.分解法 | C.电解法 | D.以上三种方法均是 |
A
铝热法炼铁的化学方程式是:Fe2O3+2Al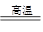 2Fe+Al2O3.这种金属冶炼的方法属于热还原法;
2Fe+Al2O3.这种金属冶炼的方法属于热还原法;
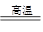 2Fe+Al2O3.这种金属冶炼的方法属于热还原法;
2Fe+Al2O3.这种金属冶炼的方法属于热还原法;
练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
题目内容
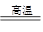 2Fe+Al2O3.这种金属冶炼的方法属于
2Fe+Al2O3.这种金属冶炼的方法属于| A.还原法 | B.分解法 | C.电解法 | D.以上三种方法均是 |
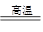 2Fe+Al2O3.这种金属冶炼的方法属于热还原法;
2Fe+Al2O3.这种金属冶炼的方法属于热还原法;
 发散思维新课堂系列答案
发散思维新课堂系列答案