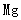题目内容
高纯碳酸锰广泛应用于电子工业,是制造高性能磁性材料的主要原料。新工艺采用工业冶铜后的废气SO2进行湿法浸取软锰矿(主要含MnO2,同时含有少量SiO2、Fe2O3、Al2O3)来制备。(已知亚硫酸酸性强于碳酸)
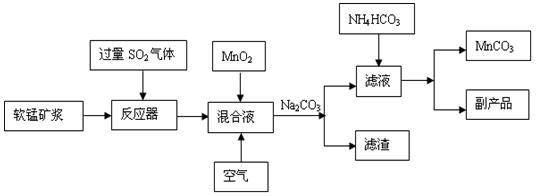
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:
已知生成氢氧化物的pH如下表:
请根据题中有关信息回答问题:
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
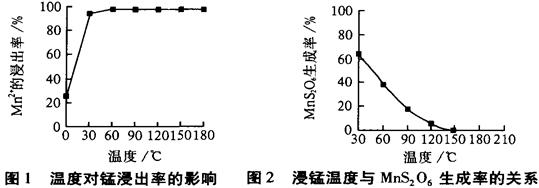
(2)由图可知,副反应MnSO4+ SO2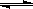 MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是 (写两点)。
①将过量的SO2气体通入软锰矿浆中进行“浸锰”操作,并控制温度加热反应;
②向浸锰结束后的滤液中加入MnO2、同时通入空气,再用Na2CO3溶液调节pH为3.7后
过滤分离;
③调节滤液pH值为6.5~7.2 ,然后加入NH4HCO3 ,有浅红色的沉淀生成,过滤洗涤干燥后就可以得到高纯碳酸锰。
工业流程图如下:


已知生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
(1)“浸锰”后所得混合液中主要存在的金属阳离子有 。
(2)由图可知,副反应MnSO4+ SO2
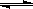 MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。
MnS2O6的△H 0(填>、<或=),为减少MnS2O6的生成,“浸锰”的适宜温度是 。(3)步骤②中加入MnO2和通入空气的作用 。
(4)③中控制温度为60~70℃,温度不宜太高的原因是 。
(5)与传统的电解法制MnCO3工艺相比较,新工艺的优点是 (写两点)。
(1)Mn2+、Fe2+、Al3+ (2)<; 150℃
(3)通入空气将Fe2+氧化成Fe3+便于后来加碳酸钠除去;加入MnO2是为了除去过量的SO2(4)防止NH4HCO3受热分解
(5)综合利用了尾气SO2有利于环境保护,同时节约能源。
(3)通入空气将Fe2+氧化成Fe3+便于后来加碳酸钠除去;加入MnO2是为了除去过量的SO2(4)防止NH4HCO3受热分解
(5)综合利用了尾气SO2有利于环境保护,同时节约能源。
略

练习册系列答案
相关题目
 2Fe+Al2O3.这种金属冶炼的方法属于
2Fe+Al2O3.这种金属冶炼的方法属于