题目内容
14.下列说法不正确的是( )| A. | 海水中蕴含的元素有80多种,海洋是一个巨大的宝库 | |
| B. | 海水中氯化物的含量最高 | |
| C. | 海水中的氯化物的主要是氯化钠,其次是氯化镁,氯化钙,氯化钾等 | |
| D. | 海水中含有浓度较小的碘元素和溴元素 |
分析 A、海水中含有丰富的元素,是宝贵的资源库;
B、海水中的主要成分为氯化钠;
C、海水中的氯化物的主要是氯化钠、氯化镁,氯化钙,氯化钾等;
D、海水中的碘元素和溴元素浓度都不高,但由于海水量很大,所以其质量很大.
解答 解:A、海水的成分是很复杂的.海水中化学元素的含量差别很大.除氢和氧外,每升海水中含量在 1 毫克以上的元素有Cl、Na、Mg、S、Ca、K、Br、C、Sr、B 和 F 11种,一般称为“主要元素”.每升海水中含量在 1 毫克以下的元素,叫“微量元素”或“痕量元素,是巨大的资源宝库,故A正确;
B、海水中含量最多的盐是氯化钠,海水中水中最多,故B错误;
C、海水中的氯化物的主要是氯化钠,其次是氯化镁,氯化钙,氯化钾等,故C正确;
D、由于海水量很大,海水中的碘元素和溴元素浓度都不高,99%的溴元素存在于海水,碘太低,仅有 60μ g/L,故D正确;
故选B.
点评 本题考查了海水资源的分析判断,海水成分的获取方法和存在形式,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 苯酚与碳酸氢钠溶液反应:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O | |
| B. | 溴乙烷转化成乙醇:C2H5Br+OH- $→_{△}^{水}$C2H5OH+Br- | |
| C. | 肥皂液加入醋酸:C17H35COO-+H+→C17H35COOH | |
| D. | 甲醛溶液与足量的新制Cu(OH)2共热:HCHO+2Cu(OH)2+OH-$\stackrel{△}{→}$HCOO-+Cu2O↓+3H2O |
2.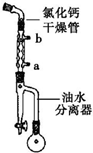 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
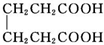 +2C2H5OH$?_{甲苯/△}^{浓硫酸}$
+2C2H5OH$?_{甲苯/△}^{浓硫酸}$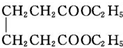 +2H2O
+2H2O
实验步骤如下:
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.
步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)图中冷凝管中冷却水从a(填“a”或“b”)口进,浓硫酸的主要作用是作催化剂.
(2)回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇).
(3)实验中加入过量的乙醇的目的是提高己二酸的转化率.
(4)步骤2实验已完成的标志是无馏分蒸出.
(5)本实验的产率为90.8%.
 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下: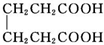 +2C2H5OH$?_{甲苯/△}^{浓硫酸}$
+2C2H5OH$?_{甲苯/△}^{浓硫酸}$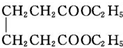 +2H2O
+2H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 己二酸二乙酯 | 202 | 1.01 | 245 | 不溶于水 |
| 己二酸 | 146 | 1.36 | 231.8 | 微溶 |
| 乙醇 | 46 | 0.79 | 78.4 | 混溶 |
| 甲苯 | 92 | 0.87 | 110.6 | 不溶于水 |
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.
步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)图中冷凝管中冷却水从a(填“a”或“b”)口进,浓硫酸的主要作用是作催化剂.
(2)回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇).
(3)实验中加入过量的乙醇的目的是提高己二酸的转化率.
(4)步骤2实验已完成的标志是无馏分蒸出.
(5)本实验的产率为90.8%.
9.甲乙两烧杯中各盛有300mL 1mol/L盐酸和氢氧化钠,向两烧杯中分别加入等质量的铝粉.反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉质量为( )
| A. | 5.4g | B. | 3.6g | C. | 2.7g | D. | 1.8g |
19.实验测定NaHCO3溶液显碱性,下列说法中正确的是( )
| A. | 在水溶液中,HCO3-仅仅发生水解 | |
| B. | 在水溶液中,HCO3-仅仅发生电离 | |
| C. | 在水溶液中,HCO3-的水解程度要大于电离程度 | |
| D. | 在水溶液中,HCO3-的电离程度要大于水解程度 |
3.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 常温常压下,11.2 L 氯化氢气体中含有的分子数为0.5NA | |
| C. | NA个甲烷分子和1mol甲烷的质量相等 | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |
4.Mg、Al、Fe分别与足量的HC1反应,产生的气体在相同状况下,均是5.6升,则Mg、Al、Fe三种金属物质的量比为( )
| A. | 3:2:2 | B. | 2:3:2 | C. | 2:2:3 | D. | 3:2:3 |
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: