题目内容
9.甲乙两烧杯中各盛有300mL 1mol/L盐酸和氢氧化钠,向两烧杯中分别加入等质量的铝粉.反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉质量为( )| A. | 5.4g | B. | 3.6g | C. | 2.7g | D. | 1.8g |
分析 根据铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,应结束后测得生成的气体体积比为甲:乙=1:2,由化学反应方程式可知,酸与金属反应时酸不足,碱与金属反应时碱过量来计算解答.
解答 解:盐酸和氢氧化钠溶液中溶质的物质的量均为0.3L×1mol/L=0.3mol,
又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6HCl═2AlCl3+3H2↑
6 3
0.3mol x
$\frac{6}{0.3}=\frac{3}{x}$,解得x=0.15mol,
一定条件下,气体的物质的量之比等于体积之比,
则碱与金属铝反应生成的氢气的物质的量为0.15mol×2=0.3mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.3mol
$\frac{2}{y}=\frac{3}{0.3}$,解得y=0.2mol,
则铝的质量为0.2mol×27g/mol=5.4g,
故选A.
点评 本题考查学生利用化学反应方程式的计算,明确铝与酸、碱反应水的化学反应方程式,酸碱足量、酸碱均不足量时得到的氢气的关系是解答本题的关键.

练习册系列答案
相关题目
19.关于如图所示的原电池,下列说法正确的是( )
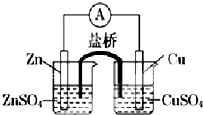

| A. | 电子沿着盐桥从锌电极流向铜电极 | |
| B. | 盐桥中的阳离子向硫酸铜溶液中迁移 | |
| C. | 电流从锌电极通过电流计流向铜电极 | |
| D. | 铜电极上发生的电极反应是2H++2e-═H2↑ |
20.能用于鉴别淀粉、肥皂和蛋白质三种溶液的试剂是( )
| A. | 碘水 | B. | 烧碱溶液 | C. | 浓硝酸 | D. | Na2SO4溶液 |
17.下列芳香烃中一氯代物的同分异构体种类最多的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列说法不正确的是( )
| A. | 海水中蕴含的元素有80多种,海洋是一个巨大的宝库 | |
| B. | 海水中氯化物的含量最高 | |
| C. | 海水中的氯化物的主要是氯化钠,其次是氯化镁,氯化钙,氯化钾等 | |
| D. | 海水中含有浓度较小的碘元素和溴元素 |
1.向含有下列离子的溶液中分别加入烧碱固体(溶液的体积变化可忽略),能引起下列离子浓度增大的是( )
| A. | HCO3- | B. | Cl- | C. | OH- | D. | Cu2+ |
18.表中,陈述I、Ⅱ均正确,且陈述Ⅱ是陈述I的结论的一组是( )
| 选项 | 陈述I | 陈述Ⅱ |
| A | 苯不能使酸性高锰酸钾溶液褪色;甲苯能使酸性高锰酸钾溶液褪色. | 甲基使苯环性质变活泼 |
| B | 与浓硫酸、浓硝酸混合物发生一元硝化反应时,苯需60℃,而甲苯只需30℃ | 苯环使甲基性质变活泼 |
| C | CH2=C(CH3)CH=CH2和Br2在一定条件下物质的量1:1发生加成反应,可生成3种有机物. | CH2=C(CH3)CH=CH2可发生1,2加成和1,4加成. |
| D | 卤代烷中加入NaOH乙醇共热,冷却后滴入AgNO3溶液,则有白色沉淀生成 | 卤代烷是氯代烷 |
| A. | A | B. | B | C. | C | D. | D |
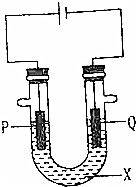 为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.
为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.