题目内容
4.Mg、Al、Fe分别与足量的HC1反应,产生的气体在相同状况下,均是5.6升,则Mg、Al、Fe三种金属物质的量比为( )| A. | 3:2:2 | B. | 2:3:2 | C. | 2:2:3 | D. | 3:2:3 |
分析 金属Mg、Fe与盐酸反应都表现为+2价,Al表现为+3价,利用电子转移守恒,生成等量的氢气转移电子是一样的,所以转移等量电子消耗的Mg、Al、Fe三种金属物质的量比即为答案.
解答 解:标准状况下为5.6L气体的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,
金属Mg、Fe与盐酸反应都表现为+2价,Al表现为+3价,利用电子转移守恒,生成等量的氢气转移电子是一样的,转移等量电子(假设是1mol)消耗三种金属的物质的量之比是:$\frac{1}{2}$mol:$\frac{1}{3}$mol:$\frac{1}{2}$mol=3:2:3,故选D.
点评 本题考查化学方程式的有关计算,难度中等,可以利用方程式结合电子守恒判断金属与氢气的物质的量关系得到答案.

练习册系列答案
相关题目
14.下列说法不正确的是( )
| A. | 海水中蕴含的元素有80多种,海洋是一个巨大的宝库 | |
| B. | 海水中氯化物的含量最高 | |
| C. | 海水中的氯化物的主要是氯化钠,其次是氯化镁,氯化钙,氯化钾等 | |
| D. | 海水中含有浓度较小的碘元素和溴元素 |
12.下列物质间不能发生离子反应的是( )
| A. | 2AgNO3+MgCl2═2AgCl↓+Mg(NO3)2 | B. | K2CO3+Ca(OH)2═CaCO3↓+2KOH | ||
| C. | CaCl2+CO2+H2O═CaCO3↓+2HCl | D. | HCl+KOH═KCl+H2O |
9.下列物质是烷烃的是( )
| A. | CH2Br-CH2Br | B. | C5H11OH | C. | C100H202 | D. | C6H6 |
10.下列叙述正确的是( )
| A. | 将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 | |
| B. | 不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 | |
| C. | 实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 | |
| D. | 定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低 |
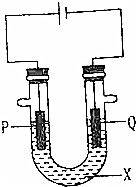 为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.
为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.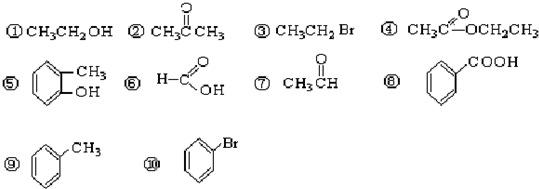
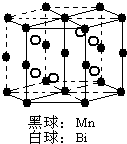 氮磷砷锑铋位于周期表第ⅤA族,它们的单质及其化合物在社会生产生活中有广泛应用,请回答有关问题:
氮磷砷锑铋位于周期表第ⅤA族,它们的单质及其化合物在社会生产生活中有广泛应用,请回答有关问题: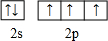 .
.