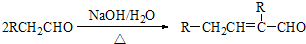题目内容
2. 己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下:
己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下: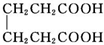 +2C2H5OH$?_{甲苯/△}^{浓硫酸}$
+2C2H5OH$?_{甲苯/△}^{浓硫酸}$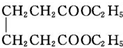 +2H2O
+2H2O| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 己二酸二乙酯 | 202 | 1.01 | 245 | 不溶于水 |
| 己二酸 | 146 | 1.36 | 231.8 | 微溶 |
| 乙醇 | 46 | 0.79 | 78.4 | 混溶 |
| 甲苯 | 92 | 0.87 | 110.6 | 不溶于水 |
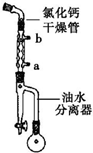
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.
步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)图中冷凝管中冷却水从a(填“a”或“b”)口进,浓硫酸的主要作用是作催化剂.
(2)回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇).
(3)实验中加入过量的乙醇的目的是提高己二酸的转化率.
(4)步骤2实验已完成的标志是无馏分蒸出.
(5)本实验的产率为90.8%.
分析 (1)根据逆流冷却效果好,判断冷却水的进口,在酯化反应中浓硫酸作催化剂;
(2)由于水和乙醇的沸点比己二酸二乙酯和己二酸都要低,容易形成蒸汽,并在冷凝管被冷凝而留在油水分离器中,据此答量;
(3)酯化反应是可逆反应,增加一种反应物可以提高另一种反应物的转化率;
(4)步骤2中在120℃左右充分蒸馏,当无馏分蒸出,就可说明蒸馏操作完成;
(5)己二酸0.012mol与乙醇0.076mol反应,根据酯化反应的方程式可知,乙醇过量,所以理论上产生己二酸二乙酯的物质的量为0.012mol,即质量为146g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)根据逆流冷却效果好,所以冷却水的进口为a,在己二酸与乙醇发生的酯化反应中浓硫酸作催化剂,
故答案为:a;作催化剂;
(2)由于水和乙醇的沸点比己二酸二乙酯和己二酸都要低,容易形成蒸汽,并在冷凝管被冷凝而留在油水分离器中,所以回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇),
故答案为:水(或水和乙醇);
(3)酯化反应是可逆反应,增加一种反应物可以提高另一种反应物的转化率,所以实验中加入过量的乙醇的目的是提高己二酸的转化率,
故答案为:提高己二酸的转化率;
(4)步骤2中在120℃左右充分蒸馏,当无馏分蒸出,就可说明蒸馏操作完成,
故答案为:无馏分蒸出;
(5)己二酸0.012mol与乙醇0.076mol反应,根据酯化反应的方程式可知,乙醇过量,所以理论上产生己二酸二乙酯的物质的量为0.012mol,即质量为202×0.012g=2.424g,所以己二酸二乙酯的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{2.2g}{2.424g}$×100%=90.8%,
故答案为:90.8%.
点评 本题考查己二酸二乙酯的制备以及注意事项,题目难度中等,明确实验目的和实验原理是解答该题的关键.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 氧化剂在反应中得到的电子越多,氧化能力越强 | |
| B. | Cl2既可以作氧化剂,又可作还原剂 | |
| C. | Cu2+的氧化性比Fe2+强 | |
| D. | 在氧化还原反应中,氧化剂得到的电子总数一定等于还原剂失去的电子总数 |
| A. | 海水中蕴含的元素有80多种,海洋是一个巨大的宝库 | |
| B. | 海水中氯化物的含量最高 | |
| C. | 海水中的氯化物的主要是氯化钠,其次是氯化镁,氯化钙,氯化钾等 | |
| D. | 海水中含有浓度较小的碘元素和溴元素 |
| A. | 属于有机高分子材料 | B. | 大量使用会产生“白色污染” | ||
| C. | 生产原理符合“绿色化学”思想 | D. | 工业上通过乙烷加聚合成 |
| A. | 2AgNO3+MgCl2═2AgCl↓+Mg(NO3)2 | B. | K2CO3+Ca(OH)2═CaCO3↓+2KOH | ||
| C. | CaCl2+CO2+H2O═CaCO3↓+2HCl | D. | HCl+KOH═KCl+H2O |
 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,