题目内容
[化学-选修3:物质结构与性质]
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)砷的基态原子的电子排布式为 .
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主.Ga和As相比,电负性较大的 是 ,GaAs中Ga的化合价为
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;AsH3的沸点高于PH3,其主要原因为
(4)Na3As04可作杀虫剂.As043-的立体构型为 与其互为等电子体的分子的化学式为 (任写一种).
(5)H3As04和H3As03是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比 H3AsO3 酸性强的原因 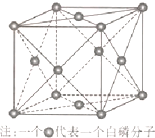
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图.已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为 g/cm3(只要求列算式,不必计算)
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)砷的基态原子的电子排布式为
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主.Ga和As相比,电负性较大的 是
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为
(4)Na3As04可作杀虫剂.As043-的立体构型为
(5)H3As04和H3As03是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比 H3AsO3 酸性强的原因

(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图.已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为
分析:(1)As的原子序数为33,根据构造原理书写其核外电子排布;
(2)同周期随原子序数递增电负性增大;根据化合价代数和为0计算;
(3)AsH3中As原子成3个As-H键、含有一对孤对电子,杂化轨道数为4;都属于分子晶体,相对分子质量越大范德华力越大,熔沸点越高;
(4)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×
=0,为sp3杂化;等电子体的原子数和价电子数(或电子总数)相同;
(5)比较非羟基氧多少结合As原子化合价判断,非羟基氧越多、As化合价越高则酸性越强;
(6)根据均摊法计算晶胞中白磷(P4)分子数目,计算晶胞的质量、晶胞的体积,根据ρ=
计算晶胞密度.
(2)同周期随原子序数递增电负性增大;根据化合价代数和为0计算;
(3)AsH3中As原子成3个As-H键、含有一对孤对电子,杂化轨道数为4;都属于分子晶体,相对分子质量越大范德华力越大,熔沸点越高;
(4)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×
| 1 |
| 2 |
(5)比较非羟基氧多少结合As原子化合价判断,非羟基氧越多、As化合价越高则酸性越强;
(6)根据均摊法计算晶胞中白磷(P4)分子数目,计算晶胞的质量、晶胞的体积,根据ρ=
| m |
| V |
解答:解:(1)As的原子序数为33,由构造原理可知电子排布为1s22s22p63s23p63d104s24p3,
故答案为1s22s22p63s23p63d104s24p3;
(2)同周期随原子序数递增电负性增大,Ga和As同周期,As的原子序数较大,故电负性较大的是As;As处于Ⅴ
A族,电负性较大,表现-3价,故Ga为+3价,
故答案为:As;+3;
(3)AsH3中As原子成3个As-H键、含有一对孤对电子,杂化轨道数为4,As原子采取sp3杂化;AsH3和PH3形成的晶体均是分子晶体,其沸点受分子间作用力大小的影响,对于组成和结构相似的物质分子间作用力和其相对原子质量成正比,所以AsH3的沸点高于PH3,
故答案为:sp3;AsH3的相对分子质量比PH3的大,分子间作用力大,因而AsH3的沸点比PH3高;
(4)AsO43-中As原子价层电子数为4+
=4、含有的孤电子对数是0,所以其构型是正四面体形,AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为CF4、SiF4、CCl4、SiCl4等,
故答案为:正四面体;CCl4等;
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3 As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+,
故答案为:H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3 As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+;
(5)由晶胞结构可知,晶胞中白磷(P4)分子数目=8×
+6×
=4,则晶胞的质量=
g,两个白磷分子间距离为 a pm,最近的分子处于面的对角线上,令晶胞棱长=2a pm×
=
a pm,则晶胞的体积=(
a×10-10cm)3=(
a×10-10)3 cm3,故晶胞的密度=
=
g/cm3,
故答案为:
.
故答案为1s22s22p63s23p63d104s24p3;
(2)同周期随原子序数递增电负性增大,Ga和As同周期,As的原子序数较大,故电负性较大的是As;As处于Ⅴ
A族,电负性较大,表现-3价,故Ga为+3价,
故答案为:As;+3;
(3)AsH3中As原子成3个As-H键、含有一对孤对电子,杂化轨道数为4,As原子采取sp3杂化;AsH3和PH3形成的晶体均是分子晶体,其沸点受分子间作用力大小的影响,对于组成和结构相似的物质分子间作用力和其相对原子质量成正比,所以AsH3的沸点高于PH3,
故答案为:sp3;AsH3的相对分子质量比PH3的大,分子间作用力大,因而AsH3的沸点比PH3高;
(4)AsO43-中As原子价层电子数为4+
| 5+3-2×4 |
| 2 |
故答案为:正四面体;CCl4等;
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3 As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+,
故答案为:H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3 As,H3AsO3中的As为+3价,而H3AsO4中非羟基氧较多、As为+5价,正电性更高,导致As-O-H中的O的电子更向As偏移,越易电离出H+;
(5)由晶胞结构可知,晶胞中白磷(P4)分子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×124 |
| NA |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| ||
(
|
| 496 | ||
NA(
|
故答案为:
| 496 | ||
NA(
|
点评:本题考查较综合,涉及电子排布、电负性、杂化类型、分子结构与性质、等电子体、晶胞计算等,注意掌握含氧酸酸性强弱的比较,(5)中计算晶胞的棱长是解题关键,注意最近的分子处于面的对角线上.

练习册系列答案
相关题目
 (2012?许昌三模)[化学--选修3:物质结构与性质]砷(As)是一种重要的化学元素,其可形成多种用途广泛的化合物.
(2012?许昌三模)[化学--选修3:物质结构与性质]砷(As)是一种重要的化学元素,其可形成多种用途广泛的化合物. 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】