题目内容
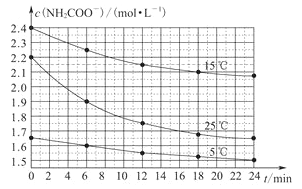
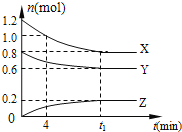
【题目】在体积为2L的恒容密闭容器中发生反应![]() ,图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始
,图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始![]() :
:![]() 的变化关系。下列结论正确的是
的变化关系。下列结论正确的是![]()
![]()

A.![]() 时,反应从开始到平衡的平均速率
时,反应从开始到平衡的平均速率![]()
B.由图乙知反应![]() 的
的![]() ,且
,且![]()
C.若在图甲所示的平衡状态下,再向体系中充入0.2 mol B和0.2 mol C,重新达到平衡前![]() 正
正![]() 逆
逆![]()
D.在![]() 时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于
时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于![]()
【答案】A
【解析】
图甲可知,![]() 时平衡时,A的物质的量变化量为
时平衡时,A的物质的量变化量为![]() ,B的物质的量变化量为0.4 mol -0.2 mol =
,B的物质的量变化量为0.4 mol -0.2 mol = ![]() ,C的物质的量变化量为0.2mol,各物质变化的物质的量之比等于化学计量数之比,所以反应方程式为:2A(g)+B(g)
,C的物质的量变化量为0.2mol,各物质变化的物质的量之比等于化学计量数之比,所以反应方程式为:2A(g)+B(g)![]() C(g)。可计算平衡常数K=
C(g)。可计算平衡常数K=![]() =25。
=25。
A.由图甲可知,![]() 时5min达到平衡,平衡时B的物质的量变化量为
时5min达到平衡,平衡时B的物质的量变化量为![]() ,故
,故
![]() ,故A正确;
,故A正确;
B.在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比![]() :
:![]() 。由图乙可知,
。由图乙可知,![]() :
:![]() 一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即
一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即![]() ,故B错误;
,故B错误;
C.恒温恒容条件下,再向体系中充入0.2 mol B和0.2 mol C,由于B和C的化学计量数相等,所以Qc=K,平衡不移动,故![]() ,故C错误;
,故C错误;
D.由图Ⅰ可知,![]() 时平衡时,A、B、C的物质的量变化量分别为
时平衡时,A、B、C的物质的量变化量分别为![]() 、
、![]() 、
、![]() ,物质的量之比等于化学计量数之比,故x:y:
,物质的量之比等于化学计量数之比,故x:y:![]() :
:![]() :
:![]() :1:1,平衡时A的体积分数为
:1:1,平衡时A的体积分数为![]() ,
,![]() 时,向容器中充入2molA和1molB达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时,A的体积分数小于
时,向容器中充入2molA和1molB达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时,A的体积分数小于![]() ,故D错误。
,故D错误。
故选A。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0. 20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为__________________________,表中b_________c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为__________________mol·L-1,0~20s内N2O4的平均反应速率为________________;
(3)该反应的平衡常数表达式K=___________________
在80℃时该反应的平衡常数K值为:______________(保留到小数点后2位)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时____________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大