题目内容
【题目】某研究小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
NH4HCO3+NH3·H2O,测得c(NH2COO-)与反应时间的关系如图所示。据图判断下列说法正确的是
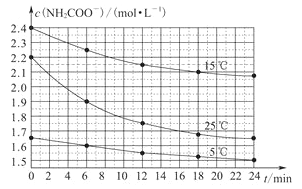
A.0~12min,初始浓度越大的实验,水解反应速率越大
B.c(NH2COO-)将随反应时间的不断延长而不断减小
C.25℃时,0~6min,v(NH2COO-)为0.05mol·L-1·min-1
D.15℃时,第30min,c(NH2COO-)为2.0mol·L-1
【答案】C
【解析】
A.0~12 min时,反应速率大的曲线的斜率较大,所以25℃时的反应速率最大,而15℃时的初始浓度最大,所以不是初始浓度大的反应速率大,错误;
B.该反应是可逆反应,所以随时间的不断延长,达到平衡状态,c(NH2COO-)逐渐减小至不变,错误;
C.25 ℃时0~6 min,NH2COO-的浓度从2.2mol/L减少到1.9mol/L,浓度减少了0.3mol/L则v(NH2COO-)=0.3mol/L÷6min=0. 05 mol·L-1·min-1,正确;
D.15 ℃时,第22min时已达平衡状态,所以第30 min时,c(NH2COO-)>2.0mol/L ,错误。
答案选C。

练习册系列答案
相关题目