题目内容
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,同时(NH4)2S2O8被还原为SO42-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为____。
(2)该反应的离子方程式为____。
(3)已知H2S2O8中硫的化合价为+6,若硫酸的结构简式为![]() ,则H2S2O8的结构简式为____。
,则H2S2O8的结构简式为____。
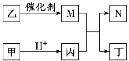
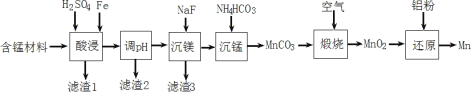
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如图所示。
已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5molL-1时,可认为该离子沉淀完全。
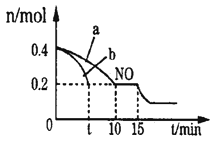
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为____;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
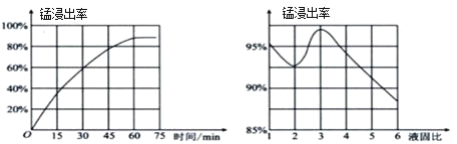
则适宜的浸出时间和液固比分别为____、____。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为____。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为____。“还原”时发生的置换反应在化学上又叫作____。
【答案】溶液由无色变为紫红色 5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+ 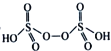 3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 60min 3:1(或3)
3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 60min 3:1(或3) ![]() ≤pH<8(或4.7≤pH<8) 1:2 铝热反应
≤pH<8(或4.7≤pH<8) 1:2 铝热反应
【解析】
Ⅰ.⑴高锰酸根是紫红色,Mn2+是无色。
⑵根据S2O82与Mn2+反应生成MnO4-、SO42原理书写离子方程式。
⑶硫酸的结构简式为![]() ,H2S2O8中含有过氧根,书写其结构简式。
,H2S2O8中含有过氧根,书写其结构简式。
Ⅱ “酸浸”时,MnO2将Fe氧化为Fe3+,自身变为Mn2+,氧化铝、氧化镁变为溶液,二氧化硅是滤渣1,调节pH将铁离子和铝离子沉淀完全得到滤渣2,加入NaF沉淀镁离子得到滤渣3,加入碳酸氢铵与锰离子反应生成碳酸锰,过滤后与氧气煅烧生成二氧化锰,再经铝热反应生成锰。
Ⅰ⑴Mn2+是无色,高锰酸根是紫红色,因此酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为溶液由无色变为紫红色;故答案为:溶液由无色变为紫红色。
⑵该反应的离子方程式为5S2O82+2Mn2++8H2O=2MnO4-+10SO42+16H+;故答案为:5S2O82+2Mn2++8H2O=2MnO4-+10SO42+16H+。
⑶已知H2S2O8中硫的化合价为+6,若硫酸的结构简式为![]() ,则H2S2O8中含有过氧根,其结构简式为
,则H2S2O8中含有过氧根,其结构简式为 ;故答案为:
;故答案为: 。
。
Ⅱ⑴“酸浸”时,MnO2将Fe氧化为Fe3+,自身变为Mn2+,其反应的离子方程式为3MnO2+ 2Fe + 12H+=3Mn2++2Fe3++6H2O;该过程中浸出时间60min达到80%,以后浸出率不再上升,液固比等于3时锰浸出率最大,因此适宜的浸出时间和液固比分别为60min、3:1(或3);故答案为:60min;3:1(或3)。
⑵若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,铁离子先沉淀,再是铝离子沉淀,则应“调pH”的范围在铝离子沉淀完全,而锰离子刚沉淀时,![]() ,
, ,pH =
,pH =![]() ,
,![]() ,则
,则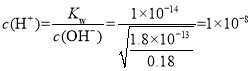 ,pH = 8,因此应“调pH”的范围为
,pH = 8,因此应“调pH”的范围为![]() ≤pH<8;故答案为:
≤pH<8;故答案为:![]() ≤pH<8。
≤pH<8。
⑶“煅烧”反应是碳酸锰和空气中氧气反应,碳酸锰中锰化合价/span>+2价变为二氧化锰+4价的锰,氧气中氧化合价降低到-2价,根据得到电子守恒得到氧化剂与还原剂的物质的量之比为1:2;“还原”时发生的置换反应是铝和二氧化锰高温反应生成锰和氧化铝,在化学上又叫作铝热反应;故答案为:1:2;铝热反应。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】实验室制备乙酸丁酯的环境温度(反应温度)是115﹣125℃,其它有关数据如下表,则以下关于实验室制备乙酸丁酯的叙述错误的是( )
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 98%浓硫酸 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
溶解性 | 溶液水和有机物 | 溶液水和有机物 | 微溶于水,溶液有机物 | 与水混合 |
A.相对价廉的乙酸与1﹣丁醇的物质的量之比应大于1:1
B.不用水浴加热是因为乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用Na2CO3溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏