题目内容
【题目】下列措施对增大反应速率明显有效的是( )
①Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
②Fe与稀硫酸反应制取H2时,改用98%浓硫酸
③Zn与稀硫酸反应制取H2时,滴加几滴CuSO4溶液
④在K2SO4与BaCl2两溶液反应时,增大压强
⑤2SO2+O2![]() 2SO3,升高温度
2SO3,升高温度
⑥Na与水反应时,增大水的用量
A. ①③⑤B. ②④⑥C. ①②③⑤D. ①⑤
【答案】A
【解析】
①、将Al片改成Al粉,增大了反应物的接触面积,所以能使反应速率加快,故正确;
②、铁和浓硫酸常温下钝化,加热反应生成的是二氧化硫气体,不放氢气,故错误;
③、Zn与加入的CuSO4溶液反应生成单质铜,形成锌铜原电池,反应速率加快,故正确;
④、压强只对气体参与的反应的反应速率有影响,对非气体参与的反应没有影响,增大压强速率不变,故错误;
⑤2SO2+O2![]() 2SO3,升高温度,化学反应速率增大,故正确;
2SO3,升高温度,化学反应速率增大,故正确;
⑥、加水不能改变浓度水的浓度,对反应速率没有影响,故错误;
综上,正确的有①③⑤。
答案选A。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】化学学习和研究离不开元素周期表。表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是______。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为______(用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式___________。
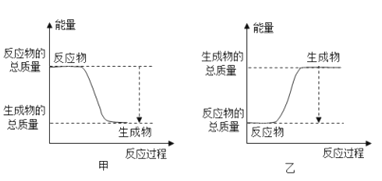
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,画出该元素的原子结构示意图______;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图______表示。![]() 填“甲“或“乙”
填“甲“或“乙”![]()
从①-⑩中任选元素,按下面要求写出一个置换反应:_____________________。要求:非金属单质1 + 化合物1→非金属单质2 + 化合物2