题目内容
【题目】下列事实不能用勒夏特列原理解释的是( )
A. FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B. 工业合成氨中,将氨气液化分离
C. A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D. 对于反应2NO2(g)![]() N2O4(g) △H<0,升高温度可使体系颜色变深
N2O4(g) △H<0,升高温度可使体系颜色变深
【答案】C
【解析】A.在FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入固体KSCN后颜色变深,是因为加入KSCN后,溶液中硫氰根离子浓度增大,使平衡正向移动,促进生成硫氰化铁,溶液颜色变深,所以可用勒夏特列原理解释,故A不选;B. 工业合成氨中,将氨气液化分离,可以促使化学平衡正向移动,提高产物的产率,可以用勒夏特列原理解释,故B不选;C. A. B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快,是因为氯化铁在反应中起到催化剂的作用,催化剂不会引起化学平衡的移动,不能用勒夏特列原理解释,故C选;D. 对于反应2NO2(g)
Fe(SCN)3+3KCl平衡体系中加入固体KSCN后颜色变深,是因为加入KSCN后,溶液中硫氰根离子浓度增大,使平衡正向移动,促进生成硫氰化铁,溶液颜色变深,所以可用勒夏特列原理解释,故A不选;B. 工业合成氨中,将氨气液化分离,可以促使化学平衡正向移动,提高产物的产率,可以用勒夏特列原理解释,故B不选;C. A. B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快,是因为氯化铁在反应中起到催化剂的作用,催化剂不会引起化学平衡的移动,不能用勒夏特列原理解释,故C选;D. 对于反应2NO2(g) ![]() N2O4(g) △H<0,升高温度,可以使化学平衡逆向移动,二氧化氮的浓度增加,所以颜色加深,可以用勒夏特列原理解释,故D不选;答案选C。
N2O4(g) △H<0,升高温度,可以使化学平衡逆向移动,二氧化氮的浓度增加,所以颜色加深,可以用勒夏特列原理解释,故D不选;答案选C。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】硫氰酸盐、苯酚及硫代硫酸盐是HPF脱硫废液中的主要污染物(其中还含有Cl-、SO![]() 、Na+等),可用NaClO3、H2SO4作脱除的试剂。
、Na+等),可用NaClO3、H2SO4作脱除的试剂。
(1)Cl2与热的NaOH溶液反应生成NaClO3,该反应的化学方程式为____________________________。
(2) 常温时,反应C6H5O-+H2O ![]() C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
C6H5OH+OH-的平衡常数为K=________(C6H5OH的Ka=1×10-10)。
(3)处理该废水需经预处理和再处理阶段。
①用浓硫酸对600 mL HPF脱硫废液进行酸化预处理(反应温度100℃),其结果如表1所示:
表1 预处理前后三种离子浓度变化情况
项目 | S2O | SCN-(g·L-1) | 苯酚(g·L-1) | pH |
处理前 | 34.28 | 70.11 | 1.3 | 8.55 |
处理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表1可知,该处理过程中主要被除去的污染物是________。
②对预处理后废液进行再处理(反应温度100 ℃)时,13次依次向废液中加入试剂情况如表2所示:
表2 13次依次加入试剂情况
次数 | 1 | 2 | 3 | 4 | span>5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
浓H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
实验结果如图1所示:
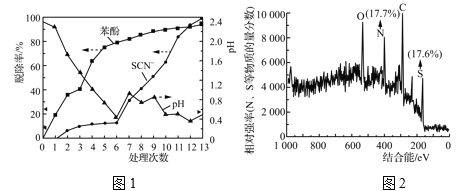
前![]() 和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
和Cl-反应产生Cl2有关。该白色沉淀可能的结构简式为______________。
③由表2和图1中数据得出,第7~13次操作中SCN-在较强酸性条件下被ClO![]() (不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
(不水解)氧化的依据是________。此过程中产生大量砖红色沉淀(夹杂少量白色沉淀),对沉淀进行XPS分析,部分元素的物质的量分数如图2所示。已知SCN-可被某些氧化剂(如Cu2+等)最终氧化为砖红色的沉淀(SCN)x。一种推测认为该实验中产生的砖红色沉淀为(SCN)x,支持该推测的证据有:________。
【题目】根据所给的信息和标志,判断下列说法正确的是
A | B | C | D |
《本草纲目拾遗》中述“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,.....,所刮下之销末,名铁线粉” | 《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者” | 可燃冰 |
|
“铁线粉”是Fe3O4 | 利用KNO3的氧化性 | “可燃冰”是可以燃烧的水 | “绿色食品”是指绿色的食品 |
A. A B. B C. C D. D