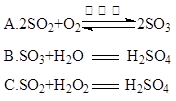题目内容
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(mL) | 0.40 | 0.10 | 0.90 | 0.00 |
| 最终读数(mL) | 25.05 | 20.10 | 21.00 | 19.90 |
| V标(mL) | 24.65 | 20.00 | 20.10 | 19.90 |
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
(13分)
(1)①查漏; ②排除滴定管尖嘴处的气泡 (各1分)
(2)酸(1分)
(3)作反应催化剂,加快KMnO4氧化H2C2O4的速率;
溶液由无色变为(紫)红色,半分钟不褪色 (各2分)
(4) 2MnO4— + 5H2C2O4 + 6H+ ="=" 2Mn2+ + 10CO2 ↑+ 8H2O (2分)
(5) 0.25 (2分)
(6) CD (2分)
(1)①查漏; ②排除滴定管尖嘴处的气泡 (各1分)
(2)酸(1分)
(3)作反应催化剂,加快KMnO4氧化H2C2O4的速率;
溶液由无色变为(紫)红色,半分钟不褪色 (各2分)
(4) 2MnO4— + 5H2C2O4 + 6H+ ="=" 2Mn2+ + 10CO2 ↑+ 8H2O (2分)
(5) 0.25 (2分)
(6) CD (2分)
试题分析:(1)滴定实验开始就检查滴定管是否合格,为检漏操作,待装液以后要排气泡。(2)KMnO4(H+)溶液具有很强的氧化性,装到酸式滴定管中。(3)MnSO4溶液做为催化剂加快反应速率。(6)A项:无影响;B项:会偏低。
点评:本题考查的是滴定实验操作,学生要注意滴定实验中操作的顺序以及规范操作,且能对有误差能进行分析出来。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
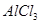 饱和溶液得纯净的
饱和溶液得纯净的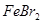 溶液中加入过量的氯水,加热蒸发得
溶液中加入过量的氯水,加热蒸发得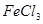 晶体
晶体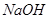 溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得
溶液,经过过滤、洗涤沉淀,再充分灼烧沉淀得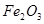
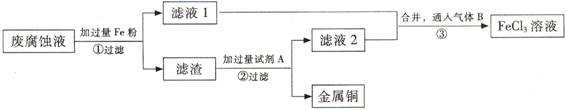 (3) 步骤①中发生反应的离子方程式
(3) 步骤①中发生反应的离子方程式