题目内容
12.已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象.据此判断下列说法正确的是( )①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.
| A. | 1mol NH4CuSO3完全反应转移0.5mol电子 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 反应中硫酸作氧化剂 |
分析 由反应现象可知,NH4CuSO3与足量的10mol/L硫酸溶液混合微热,分别发生:2Cu+=Cu+Cu2+,SO32-+2H+=H2O+SO2↑,结合反应的现象判断.
解答 解:分别发生:2Cu+=Cu+Cu2+,SO32-+2H+=H2O+SO2↑,
A.1mol NH4CuSO3完全反应,由Cu元素的化合价变化可知,0.5molCu失去0.5mol电子,即转移0.5mol电子,故A正确;
B.只有Cu元素的化合价变化,根据2Cu+=Cu+Cu2+,可知Cu元素既被氧化也被还原,故B错误;
C.根据反应SO32-+2H+=H2O+SO2↑,刺激性气味的气体是SO2,故C错误;
D.反应中S元素没有发生变化,生成SO2,显示硫酸的酸性,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,本题注意根据反应的现象判断物质的性质以及发生的反应,从化合价的变化角度分析氧化还原反应问题,题目难度不大.

练习册系列答案
相关题目
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24LCl2溶于水时转移的电子数为0.1NA | |
| B. | 过氧化钠与水反应时,生成0.1molO2时转移的电子数为0.2NA | |
| C. | 标准状况下,2.24LNO2与水反应生成NO3-的数目为0.1NA | |
| D. | 用惰性电极电解饱和食盐水,生成4.0gNaOH的同时,生成的气体分子总数为0.05NA |
7.要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO${\;}_{4}^{2-}$的数目相同,则所取两溶液的体积比是( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
17.设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a.12g 金刚石中含有的碳碳键的数目为2NA
b.1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c.1mol Na2O2与水反应转移的电子数为NA
d.常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e.标准状况下,2.24L C6H14含原子总数大于2NA
f.17g H2O2中含有的电子数为9NA
g.将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h.常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
a.12g 金刚石中含有的碳碳键的数目为2NA
b.1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c.1mol Na2O2与水反应转移的电子数为NA
d.常温下,1mol•L-1的NH4NO3溶液中含有氮原子的数目为2NA
e.标准状况下,2.24L C6H14含原子总数大于2NA
f.17g H2O2中含有的电子数为9NA
g.将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h.常温下,100mL 1mol•L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A. | a c f h | B. | a c e g | C. | a c e f h | D. | b d e h |
4.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl-.有关该电池的说法正确的是( )
| A. | AgCl为电池的正极 | |
| B. | 正极反应为Ag++e-=Ag | |
| C. | 该电池一定不能被MgCl2溶液激活 | |
| D. | 可用于海上应急照明供电,直接将化学能转化为光能 |
1.设NA为阿伏加德罗常数的数值,在常温常压下,下列说法正确的是( )
| A. | 18g水所含分子数目为NA,体积约为24.5L | |
| B. | 0.1mol•L-1的NaNO3溶液中含有0.1NA个NO3- | |
| C. | 1mol Fe与足量的盐酸反应,转移3NA个电子 | |
| D. | 2.3g钠离子所含电子数目为1NA |
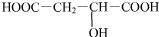 .
.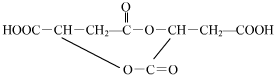 、
、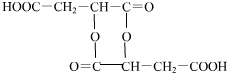 、
、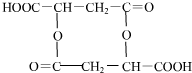 .
.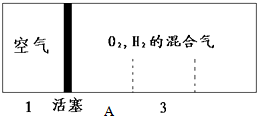 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央A处,则原来H2、O2的体积比最接近于7:2 或4:5;此比例的H2和O2混合气体的平均摩尔质量为8.67g/mol或18.67g/mol.