题目内容
7.要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO${\;}_{4}^{2-}$的数目相同,则所取两溶液的体积比是( )| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
分析 结合n=cV、N=nNA及物质构成计算.
解答 解:设所取两溶液的体积分别为x、y,
溶液中所含SO42-的数目相同,则
x×c×1×NA=y×c×3×NA,
解得x:y=3:1,
故选B.
点评 本题考查物质的量的计算,把握物质的量为中心的基本计算公式为解答本题的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
17.已知,T℃温度下,反应:N2(g)+3H2(g)?2NH3(g)△H<0的平衡常数K=9.向容积固定的某真空容器中充入N2(g)、H2(g)和NH3(g),使其浓度分别为3mol/L、1mol/L和50mol/L,在T℃温度下发生上述反应.下列说法中正确的是( )
| A. | 反应开始后,反应要放出能量 | |
| B. | 建立平衡状态时c(N2)<3 mol/L | |
| C. | 该条件下,平衡时N2的体积分数为$\frac{1}{14}$ | |
| D. | 反应条件变化时,其K值也一定发生变化 |
2.我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,曾经挽救了数百万人的生命,近日获得诺贝尔生理与医学奖,成为我国获得诺贝尔科学奖的第一人.下列关于青蒿素的叙述错的是( )
| A. | 青蒿素的一个分子中的含有42个原子 | |
| B. | 青蒿素中碳元素的质量分数约为63.8% | |
| C. | 青蒿素的相对分子质量为282 | |
| D. | 0.1mol青蒿素的质量为28.2 |
12.已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象.据此判断下列说法正确的是( )
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.
| A. | 1mol NH4CuSO3完全反应转移0.5mol电子 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 反应中硫酸作氧化剂 |
19.中学常见的某反应的化学方程式为a+b→c+d+H2O (未配平,反应条件略去).下列叙述不正确的是( )
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O═4H++SO${\;}_{4}^{2-}$+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g.mol-'1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0. 056 mol.L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-═CO${\;}_{3}^{2-}$+3HCO${\;}_{3}^{-}$+H2O |
16.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 向氢氧化钠溶液中通入二氧化碳:2OH-+CO2=CO32-+H2O | |
| C. | 澄清石灰水与稀盐酸反应:Ca (OH)2+2H+=Ca2++2H2O | |
| D. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
17.下列物质中,水溶液能导电,但本身属于非电解质的是( )
| A. | 金属铁 | B. | 干冰 | C. | 酒精 | D. | 硫酸钡 |
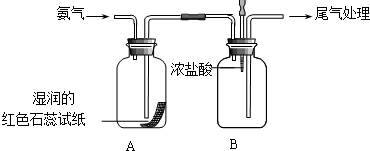 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质. 工业电解饱和食盐水模拟装置的结构如图所示:
工业电解饱和食盐水模拟装置的结构如图所示: .
.