题目内容
2.(1)在1.01×l05 Pa时,4g氢气完全燃烧生成液态水,放出572kJ的热量,写出表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol.(2)已知中和热△H=-57.3kj/mol,写出稀硫酸与氢氧化钠的稀溶液发生中和反应的热化学方程式:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(3)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2 (g)═CO2(g)△H1<0①
途径II:先制成水煤气:C(s)+H2O( g)═CO(g)+H2 (g)△H2>0②
再燃烧水煤气:CO(g)+$\frac{1}{2}$O2 (g)=CO2 (g)△H3<0 ③
H2(g)+$\frac{1}{2}$02(g)=H20(g)△H4<0 ④
请回答下列问题:
①途径I放出的热量等于(填“大于”“等于”或“小于”)途径II放出的热量.
②△H1大于填“大于”“等于”或“小于”)△H3+△H4.
③将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点.
分析 (1)根据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=$\frac{m}{M}$计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式即可;
(2)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式进行解答;
(3)①根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;
②由盖斯定律,将途径Ⅱ的三个化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数进行相应的加减,构造出途径I的热化学方程式,据此判断△H1、△H2、△H3、△H4的数学关系式;
③固体煤经处理变为气体燃料后,根据气体燃料具有的优点分析.
解答 解:(1)4g氢气的物质的量为:n=$\frac{m}{M}$=$\frac{4g}{2g/mol}$=2mol,2molH2在O2中完全燃烧生成2.00mol液态H2O放出572kJ的热量,所以1mol氢气完全燃烧放出热量286KJ,氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol;H2的燃烧热为286KJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol;
(2)稀的强酸与强碱溶液反应的中和热为57.3kJ/mol,则稀硫酸与稀烧碱溶液中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
(3)①根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量,
故答案为:等于;
②途径Ⅱ:C(s)+H2O(g)═CO(g)+H2(g)△H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0 ③
2H2(g)+O2 (g)═2H2O(g)△H4<0 ④
由盖斯定律可知,②×2+③+④得2C(s)+2O2 (g)═2CO2(g)△H=2△H2+△H3+△H4,
所以△H1=$\frac{1}{2}$△H=$\frac{1}{2}$(2△H2+△H3+△H4)=△H2+$\frac{1}{2}$(△H3+△H4),所以△H1>△H3+△H4;故答案为:大于;
③煤通过途径Ⅱ作为燃料的意义是固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送.
故答案为:①燃料燃烧充分,利用率高;②放热多,污染小等.
点评 本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的分析判断,热化学方程式的计算应用,题目较简单.

 阅读快车系列答案
阅读快车系列答案| A. | 在稀溶液中,所有酸和碱发生中和反应放出的热量都叫中和热 | |
| B. | 在稀溶液中1mol酸和1mol碱反应放出的热量不一定相等 | |
| C. | 含1molBa(OH)2的稀溶液和1mol稀硫酸完全反应放出的热,即为中和热 | |
| D. | 将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,放出的热量为57.3 kJ |
| A. | 反应开始后,反应要放出能量 | |
| B. | 建立平衡状态时c(N2)<3 mol/L | |
| C. | 该条件下,平衡时N2的体积分数为$\frac{1}{14}$ | |
| D. | 反应条件变化时,其K值也一定发生变化 |
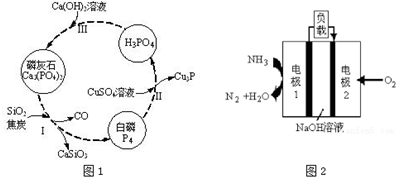
Ⅰ.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
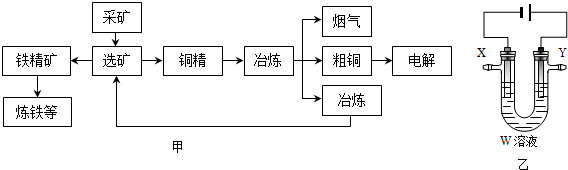
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图乙所示.下列说法不正确的是B.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
| A. | 2H2S+SO2═3S+2H2O | B. | Fe+Cu2+═Fe2++Cu | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.
| A. | 1mol NH4CuSO3完全反应转移0.5mol电子 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 反应中硫酸作氧化剂 |
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.