题目内容
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程式: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
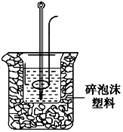
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果,该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧碱溶液,他用试剂的用量的理由是: 。在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为 次。
④若反应前溶液以及中和后的混合液的密度均设为 1 g/cm3,混合前酸与碱的温度均为 t1,混合后溶液的温度为 t2,比热容为 4.18 J/(g·℃)。那么该生测定中和热:ΔH= 。
(3)学生乙用2 mol/L的硫酸来测定与锌粒和锌粉反应的快慢,设计如图(Ⅰ)装置:
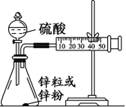
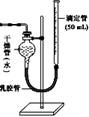
图Ⅰ 图Ⅱ
①该生两次实验测定时间均设定为10 min,那么他还要测定的另一个数据是:
。
②如果将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验完毕待冷却后,该生准备读取滴定管上液面所处的刻度数,发现滴定管中液面高于干燥管中液面,应先采取的操作是: 。
③该实验结果中,你估计与酸反应较快的是 。
(1) 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O ΔH=-57.3 kJ/mol
(2)① 温度计、环形玻璃搅拌棒
② 未用硬纸板(或塑料板)盖住烧杯 偏低
③ 保证硫酸完全反应 3
④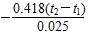 kJ/mol
kJ/mol
(3)①测定相同条件下氢气的体积
②向下移动滴定管,直到两边液面相平
③锌粉
【解析】
试题分析:(1)中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式是1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O ΔH=-57.3 kJ/mol。
(2)①由于需要测量溶液的温度以及反应还需要搅拌,所以还缺少的玻璃仪器有温度计、环形玻璃搅拌棒。
②根据装置图可知实验中没有用硬纸板(或塑料板)盖住烧杯,这样就会导致热量的损失,实验测定结果会偏低。
③氢氧化钠过量可以保证硫酸完全反应,从而减少实验误差。实验中需要测量的数据是溶液的温度,因此至少需要测量3次,即反应前酸和碱的溶液温度,以及反应后溶液的温度。
④溶液的质量是100g,反应中放出的热量是100×4.18×(t2-t1)J=0.418(t2-t1)kJ。由于反应中有0.025mol的水生成,所以中和热=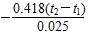 kJ/mol。
kJ/mol。
(3)①要比较反应速率的大小,除了测量时间外,还需要测定相同条件下生成氢气的体积。
②由于气体的体积受温度和压强的影响,所以必须保证气体的压强和大气压是相同的,因此正确的操作是向下移动滴定管,直到两边液面相平。
③由于锌粉的表面积大,反应速率快,即反应速率较快的是锌粉。
考点:考查热化学方程式的书写、中和热的测定以及影响反应速率的因素等
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。化学实验综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求学生必须扎实的基础,并且通过进行知识的类比、迁移、重组,全面细致的思考才能正确解答。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案下列有关热化学方程式的评价合理的是( )
|
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为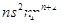 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要 (填“高”、“低”)。
(3)W2+的核外电子排布式为 。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为 (填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)
4R(s)+2Z3(g)
则16g Z2(g)完全转化为Z3(g)的△H= .
已知25 ℃、101 kPa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是
| A.金刚石比石墨稳定 | B.石墨转化为金刚石是物理变化 |
| C.石墨的能量比金刚石的能量高 | D.由石墨制备金刚石一定是吸热反应 |

 2SO3(g) △H1=
一197 kJ/mol;
2SO3(g) △H1=
一197 kJ/mol;